советы по подготовке, правила эксплуатации
Электрическая батарея автомобиля представляет собой перезаряжаемый аккумулятор, который обеспечивает электрической энергией двигатель при его запуске и позволяет функционировать всем системам транспортного средства. Работоспособность батареи определяется его выходным напряжением, которое в большей степени зависит от состава электролита для аккумуляторов.
Общая информация
Аккумуляторная батарея получила такое название потому, что она состоит из нескольких ячеек, которые располагаются одна за другой в ряд. Такое устройство является последовательным соединением электрических элементов в цепи, что позволяет увеличить выходное напряжение. Каждая ячейка батареи представляет собой закрытый сосуд, в котором расположены два электрода, погруженные в специальную жидкость — электролит, представляющий собой смесь серной кислоты и дистиллированной воды. Он выступает в качестве среды, обеспечивающей ионный обмен между электродами.
Положительные электроды — пластины, которые состоят из пентоксида свинца, а отрицательные электроды — пластины из активного свинца. Они объединяются и группируются с помощью контактных прослоек горизонтального и вертикального типа. Такая структура обеспечивает равномерное распределение электрического тока. Объединение положительных и отрицательных свинцовых пластин называется элементом. Как правило, отрицательные пластины имеют большую толщину.
Каждый элемент батареи отделяется тонкой прослойкой из пластика. Эта прослойка предотвращает возникновение короткого замыкания между рядом находящимися плюсом и минусом соседних элементов.
Между электродами и электролитом происходят электрохимические реакции, в результате которых поглощаются или выделяются электроны. Такие реакции создают разницу напряжений между электродами элемента.
На внешнюю часть корпуса аккумулятора выводятся две клеммы, с помощью которых он подсоединяется к электрической цепи. Эти клеммы расположены на верху корпуса, однако в некоторых батареях они делаются сбоку. В последнем случае возникает множество проблем, связанных с их расположением, в частности, боковые клеммы облегчают скопление паров электролита внутри батареи, что приводит к быстрому выходу из строя его рабочих элементов.
Эти клеммы расположены на верху корпуса, однако в некоторых батареях они делаются сбоку. В последнем случае возникает множество проблем, связанных с их расположением, в частности, боковые клеммы облегчают скопление паров электролита внутри батареи, что приводит к быстрому выходу из строя его рабочих элементов.
Клемма аккумулятора является либо положительной, либо отрицательной. Положительная клемма имеет больший размер, поэтому выполнить правильную установку батареи не составит никакого труда даже новичку. Если подсоединить неправильно аккумулятор, то есть перепутать плюс и минус, тогда можно повредить всю электрическую цепь.
Происходящие электрохимические реакции приводят к медленному износу активных элементов батареи, в частности, отрицательные электроды окисляются и становятся толще, а положительные электроды восстанавливаются и утончаются. По этой причине при покупке аккумулятора для автомобиля всегда следует обращать внимание на гарантийный срок службы устройства.
Аккумулятор может работать в ограниченном температурном диапазоне и плохо переносит низкие температуры, поэтому уход за ним состоит в периодических проверках напряжения на его клеммах и его механической целостности. Важно следить за наличием в батареи электролита для кислотных аккумуляторов и составом его.
Важно следить за наличием в батареи электролита для кислотных аккумуляторов и составом его.
Концентрация кислоты
Основным компонентом электролита автомобильной аккумуляторной батареи (АКБ) является концентрированная серная кислота. Но на чистой серной кислоте устройство работать не может, поэтому в составе автомобильного электролита также присутствует дистиллированная вода. Государственный стандарт ГОСТ 667–73 регулирует качество серной кислоты, поставляемой для АКБ. Важность соблюдения этого ГОСТа связаны с резким снижением срока службы устройства в случае использования грязной серной кислоты.
Плотность серной кислоты равна 1,84 г/мл, рабочее же значение плотности электролита составляет 1,3 г/мл. Следует знать, что при приготовлении электролита выделяется большое количество теплоты, поэтому не нужно забывать правило, что следует всегда лить кислоту в воду, и ни в коем случае наоборот.
Электролит, плотность которого лежит в пределе 1,07 — 1,30 г/мл, считается пригодным для работы.
Этому пределу плотности соответствует концентрация h3SO4 27−40%.
Правила эксплуатации
Свойства электролита достаточно чувствительны к смене температурного режима окружающей среды, поэтому в зонах с умеренным климатом рекомендуется проверять его состояние два раза в год: в конце осени и в конце весны.
Измерение плотности
Плотность является важной характеристикой кислотного электролита, состав которого определяет ее величину. Прибор, которым измеряется плотность электролита, называется ареометром, который можно купить в любом автомагазине. При его использовании следует учитывать температуру окружающей среды и связанный с ней поправочный коэффициент.
Следующая таблица демонстрирует поправочные коэффициенты к полученным показаниям ареометра в зависимости от температуры (градусы Цельсия):
- от -40 до -26: -0,04;
- от -25 до -11: -0,03;
- от -10 до +4: -0,02;
- от +5 до +19: -0,01;
- от +20 до +30: 0,00;
- от +31 до +45: +0,01.

Помимо ареометра, для записи измеренных результатов рекомендуется заранее приготовить чистый лист бумаги и карандаш. Проверку необходимо проводить в каждом элементе батареи отдельно. Следующие шаги объясняют порядок действий:
- Первым делом следует открыть каждую емкость в батарее, плотность электролита в которой должна быть измерена.
- Предназначенную для измерения часть ареометра нужно поместить в электролит.
- Грушей прибора следует забрать некоторую порцию электролита так, чтобы поплавок ареометра начал плавать.
- В месте соприкосновения специального стержня и жидкости следует смотреть настоящие показания измеряемой величины.
- Полученный результат записать, а затем провести аналогичные действия для оставшихся емкостей батареи.
Плотность является физической величиной, размерность которой определяется как г/см3. В случае электролита после проведенных измерений следует удостовериться, что ее колебания во всех элементах АКБ не превышают 0,2−0,3 г/см3. Если средняя величина плотности по всем емкостям АКБ лежит ниже установленного значения в паспорте, тогда необходимо зарядить аккумулятор.
Если средняя величина плотности по всем емкостям АКБ лежит ниже установленного значения в паспорте, тогда необходимо зарядить аккумулятор.
При уходе за аккумулятором и контроле плотности электролита необходимо иметь в виду температурный режим. Так, в холодное время года следует поддерживать более высокие значения этой величины (1,30 г/см3), так как она обеспечивает более низкую температуру замерзания жидкости. Например, если значение плотности лежит ниже 1,1 г/см3, то в электролите могут появляться кристаллики льда уже при температуре -6 °C. Летом же лучше снижать плотность заряженной батареи до уровня 1,23 г/см3, поскольку чем она ниже, тем дольше прослужит устройство.
Зимой при низких температурах воздуха рекомендуется снимать аккумулятор с автомобиля и заносить его в помещение, в котором следует проводить все контролирующие замеры электролитических параметров. Кроме того, для эксплуатации электроприбора в северных районах страны следует приобрести специальный контейнер-рубашку, который позволяет сохранять тепло корпуса АКБ.
Уровень жидкости
Еще одной ключевой характеристикой аккумуляторной батареи, за которой необходимо следить регулярно, является уровень электролита в каждом элементе. Согласно общим рекомендациям, он не должен быть ниже 1−1,5 см верхнего края пластин.
Перед измерением уровня электролита в каждой секции батареи следует поставить электроприбор на горизонтальную поверхность. После этого рекомендуется взять стеклянную трубку длиной 25−30 см и диаметром 5−6 мм, опустить ее на дно измеряемой банки, закрыть свободный конец трубочки большим пальцем, чтобы предотвратить спад жидкости в ней при вытягивании из банки, а затем вытянуть ее из электролита и любой линейкой измерить уровень.
Эту операцию можно провести с помощью обычного листа бумаги, который следует свернуть в трубочку и опустить на дно измеряемой емкости. При последующем измерении линейкой мокрого отпечатка на листе следует учесть величину погрешности, возникающую из-за капиллярного эффекта.
Если при измерениях обнаружен недостаток жидкости в какой-либо емкости батареи, тогда следует в нее добавить нужное количество дистиллированной воды.
Делать это следует осторожно, небольшими порциями, поскольку вода, попадая в кислоту, вызывает большое выделение теплоты и вскипание. Добавлять следует именно воду, а не электролит, в противном случае можно серьезно повредить электроприбор.
Подготовка электролита и батареи
Если старый аккумулятор вышел из строя и пришло время купить новый, то можно поступить двумя способами: во-первых, можно купить уже готовый залитый в АКБ электролит, во-вторых, можно приобрести сухозаправленную батарею и самостоятельно выполнить ее заливку. Первый способ рекомендуется для новичков, ко второму же методу следует прибегать, если прибор будет эксплуатироваться в каких-либо экстремальных условиях.
При подготовке раствора самостоятельно необходимо следующее:
- Канистра с дистиллятом, которая продается в каждом автомагазине, приобрести эту воду можно и в аптеке.

- Серная кислота h3SO4. Рекомендуется приобретать ее в разбавленном виде, то есть с плотностью 1,40 г/см3. Реже используется концентрированная кислота с плотностью 1,84 г/см3.
- Градуированная емкость, которую можно использовать, чтобы отмерять нужные порции жидкости.
- При приготовлении электролита его нужно будет мешать, поэтому следует запастись трубкой из химически инертного материала, например, из стекла или керамики.
- Резиновые перчатки, прозрачные очки, защитный фартук, старая одежда — основные средства индивидуальной защиты.
Во время приготовления раствора следует соблюдать элементарные правила химической безопасности, которые заключаются в добавлении воды в электролит не большими порциями, что может привести к вскипанию и разбрызгиванию во все стороны жидкости, а тонкой струей. При этом трубкой рекомендуется плавно перемешивать раствор.
Аккумуляторный электролит нужного состава готовится согласно инструкции на упаковке путем смешивания кислоты и дистиллята. В ряде случаев их объемы смешиваются в равных количествах. После завершения процедуры надо будет замерить плотность ареометром.
В ряде случаев их объемы смешиваются в равных количествах. После завершения процедуры надо будет замерить плотность ареометром.
В различных моделях автомобилей используют АКБ разного объема, вариации которого составляют от 2,6 до 3,7 л. В любом случае электролит можно приготовить с запасом, а оставшийся раствор необходимо нейтрализовать, бросив в него несколько ложек пищевой соды.
Как только рабочий раствор подготовлен, его нужно залить во все емкости батареи. Использовать для этого нужно либо стеклянную воронку, либо стеклянную кружку с удобным носиком. Процесс заполнения банок прибора следует проводить аккуратно и не спеша.
Заполнение производят до уровня, когда свинцовые пластины поднимаются над поверхностью электролита на 1−1,5 см. Затем прибор оставляют на 3−4 часа, при этом плотность раствора может незначительно уменьшиться.
youtube.com/embed/BOoN-Pta46A» allowfullscreen=»allowfullscreen»/>
Через несколько часов после заправки АКБ заряжают. Выполняется это так: на корпусе батареи проверяется значение емкости в Ампер-часах, это число делится на 10, и полученную величину уже используют для установления тока зарядки. Например, если емкость батареи составляет 80 А*ч, тогда ток для ее зарядки равен 8 А. Заряжать следует в течение 4 часов, после чего замеряются значения плотности и уровня электролита, и если они соответствуют рабочим величинам, тогда аккумуляторная батарея готова к использованию.
Инструкция по эксплуатации тяговых аккумуляторных батарей
Обслуживание и уход за батареями.
Правила ухода за тяговой аккумуляторной батареей, рекомендованные всеми производителями ведущих марок АКБ.
В качестве примера рассмотрена классическая батарея немецкого концерна Hawker Gmbh — Perfect Plus. Ничего сложного в уходе за батареей нет. Необходимо лишь четко по инструкции и в определенные сроки производить ряд операций, которые позволят максимально долго работать приобретенной Вами батарее, а значит, — сэкономит Ваши средства.
Особые свойства свинцовых батарей:
Емкость 5-ти часовая, т.е. номинальная емкость может быть получена при разряде постоянным током в течение 5 часов до установленного конечного напряжения разряда 1,7 В/элемент при исходной температуре ЗО С.
Напряжение Номинальное напряжение одного аккумулятора составляет 2 В. Нормы номинального напряжения тяговых батарей: 24 В, 48 В, 72В, 80 В.
Рабочее напряжение одной тяговой батарей зависит от величины тока разряда, степени разряда и температуры. Установленное конечное напряжение разряда при 5-ти часовом разряде составляет 1,7 В/элемент.
Плотность электролита в полностью заряженном состоянии, при температуре ЗО С составляет 1,29 кг/л.
Стойкость и срок службы батарей. Под стойкостью понимается результат длительного испытания в лабораторных условиях, при которых батарея подвергается циклам заряд-разряд по точно определенной программе.
 Следует получить как минимум такое количество циклов, которое не приведет к снижению емкости ниже 80% от ее номинальной величины. Соответствующая методика изложена в DIN 43539, часть 3.
Следует получить как минимум такое количество циклов, которое не приведет к снижению емкости ниже 80% от ее номинальной величины. Соответствующая методика изложена в DIN 43539, часть 3.
Действительный срок службы может быть больше или меньше чем стойкость, так как многочисленные факторы воздействия при эксплуатации ведут к нагрузкам, отличным от нагрузок в лабораторных условиях.
Факторы воздействия, ведущие к увеличению срока службы батареи:
безупречные уход и обслуживание
нормальная нагрузка
нормальные рабочие температуры (от 20 С до 40 С)
безупречные зарядные устройства
избегать глубоких разрядов
своевременное устранение неисправностей
Воздействия, ведущие к сокращению срока службы:
частые глубокие разряды, т.е. снятие более 80% номинальной емкости
повышенные рабочие температуры (> 40 С) в течение длительного времени
заряд недопустимо высоким током после достижения напряжения газообразования (2,4 В/элемент)
нахождение батареи в разряженном состоянии
наличие примеси, попавшей в электролит (например воды для долива, не соответствующей требованиям)
перегрузка или короткое замыкание
Обслуживание и уход за тяговыми батареями Общие правила эксплуатации:
Никогда не оставлять батарею в разряженном состоянии, а сразу провести повторный заряд.

Для достижения оптимального срока службы избегать разрядов более80% номинальной емкости; при этом плотность электролита не должна быть ниже 1,13 кг/л (300С).
Во избежание глубоких разрядов необходимо следить за разрядом аккумуляторов транспортных средств.
Рабочая температура должна соответствовать 20 С – 40 С.
Во избежание повреждений батареи нельзя превышать максимально допустимую температуру электролита 55 С.
Перед зарядом и при промежуточных зарядах необходимо обязательно снять или открыть крышку контейнера или закрывающее устройство батареи. Закрыть не ранее чем через 1/2 часа после окончания заряда.
Зарядные устройства должны соответствовать емкости батареи и требуемому времени заряда.
Для долива используется только дистиллированная вода согласно DIN 43530 часть 4, не следует доливать кислоту или применять добавки.
Заряд батареи (ежедневные работы):
Необходимо отключить батарею путем отсоединения штекера от розетки .
 удалить крышку батареи. При этом пробки остаются закрытыми.
удалить крышку батареи. При этом пробки остаются закрытыми.Проверить уровень электролита на отметке «мин».
После этого необходимо измерить температуру электролита. При превышении 45 С — охладить.
Подключить штекер. При необходимости соединить систему перемешивания электролита (для штекеров без интегрированной системы вывода воздуха).
Включить зарядное устройство или проверить, включено ли устройство.
Начать процесс зарядки батареи.
После зарядки отключить зарядное устройство или проверить, отключено ли устройство, затем отсоединить батарею от зарядного устройства. При необходимости проверить конечные результаты.
При недостаточном заряде или после глубокого заряда провести уравнительный заряд.
Очистка (ежедневные работы):
Грязь и пыль, которые скапливаются на поверхности элементов во время работы, необходимо удалять в зависимости от потребностей и от эксплуатации батареи (ветошь, влажный пар от 100 С до 150 С, с помощью шланга с насадкой).

Долив воды (еженедельные работы):
Необходимо также вести контроль уровня электролита. По крайней мере, один раз в неделю. В том случае, если нет автоматического долива, сделать долив очищенной воды согласно DIN 43530 часть 4 в конце заряда.
После заряда необходимо проверить уровень электролита во всех элементах и дополнить его дистиллированной водой.
Необходимо также один раз в неделю проводить уравнительный заряд.
Напряжение, плотность и температура (ежемесячные работы):
Один раз в месяц необходимо провести работу по проверке всех элементов на равномерность выделения газа.
После окончания заряда или уравнительного заряда следует измерить плотность кислоты и температуру и выборочно внести в технологическую карту батареи отклонения от нормативных величин.
Если были установлены существенные различия между элементами, то такие элементы необходимо исследовать отдельно.

Также необходимо измерить напряжение, плотность и температуру элементов.
Работы, выполняемые каждое полугодие и каждый год: .
проверить правильность функционирования зарядного устройства, в первую очередь ток заряда в начале газовыделения (2,4 В/элемент) и в конце заряда.
проверить штекер и штекерное устройство.
исправить небольшие повреждения изоляции контейнера (нанесенный слой) сразу после удаления или нейтрализации следов кислоты (соблюдать рекомендации изготовителя).
следует измерить сопротивление изоляции батарей по отношению к массе в соответствии с DIN 43539 часть 1 при разомкнутой внешней электрической цепи.
измерить сопротивление изоляции: 50 Ом на каждый Вольт номинального напряжения.
почистить батарею при плохом со противлении изоляции.
Хранение
В случае, если в течение длительного периода не планируется эксплуатация батарей, их хранение должно производиться в полностью заряженном состоянии в сухом помещении при температуре выше 0 С.
Для поддержания эксплутационной готовности батареи следует использовать следующие зарядные режимы:
Ежемесячный уравнительный заряд
Поддерживающий заряд при зарядном напряжении 2,23 В х количество элементов (30 С)
Как избежать повреждений и несчастных случаев?
Во избежание повреждений, коротких замыканий, искр, не класть металлические предметы и инструменты на батареи.
Транспортировать батареи только посредством соответствующих подъемных устройствах (согласно VDE 3616).
При работе с батареями следует соблюдать соответствующие правила техники безопасности, а также DIN VDE 0510 и VDE 0105 часть 1.
Срок хранения
Следует учитывать влияние срока хранения на срок службы батареи. Следует помнить, что правильно выбранные подъемные устройства препятствуют деформированию корпуса батареи и защищают таким образом покрытие контейнера. Подъемные устройства должны соответствовать геометрии батареи.
Подъемные устройства должны соответствовать геометрии батареи.
Рекомендации для взрывоопасных батарей
Речь идет о батареях, которые эксплуатируются в зонах повышенной взрывоопасности. Крышки корпуса батареи во время заряда и последующего отвода газов должны быть открыты с тем, чтобы образующаяся взрывоопасная газовая смесь при достаточной вентиляции потеряла свою способность к возгоранию.
Когда менять аккумулятор в автомобиле: средний срок службы АКБ
Ресурс автомобильной батареи – характеристика вольная. У одних источник питания бодро работает, старательно отмотав шесть полных лет. У других он кончается чуть ли не в разгаре второй зимы, не оставляя надежд на восстановление. Край недоумения в том, что подобные заключения могут относиться к одной и той же модели. Откуда такой диссонанс в сроке службы, когда стоит планировать смену АКБ и как продлить ее жизненный цикл – отвечает редакция Autobann.su.
Сколько в среднем служит автомобильный аккумулятор
Поводом приговорить АКБ к утилизации или, иными словами, сдать в магазин, может служить низкое напряжение под нагрузкой, быстрый заряд и быстрый разряд.
 Менее 8,5 В во время работы стартера свидетельствует о потере львиной доли заложенной с завода емкости, а быстрая подзарядка лишь подтверждает это. Внутренней причиной отмирания источника питания в 80% случаев является критическая сульфатация пластин, реже – осыпание активной массы, и очень редко – коррозия токоотводов.
Менее 8,5 В во время работы стартера свидетельствует о потере львиной доли заложенной с завода емкости, а быстрая подзарядка лишь подтверждает это. Внутренней причиной отмирания источника питания в 80% случаев является критическая сульфатация пластин, реже – осыпание активной массы, и очень редко – коррозия токоотводов.Когда случится та или иная неприятность, мы можем судить только по опыту эксплуатации батареи. Никакие тесты ускоренного характера не позволят спрогнозировать реальный срок службы. Это подтверждаем не только мы, но и коллеги из журнала «За рулем». В качестве примера можем процитировать слова зарулевцев: «Первый год интенсивных испытаний не позволил выявить явных лидеров и аутсайдеров. Все аккумуляторы ведут себя примерно одинаково».
Цифры из опыта
Указывать средний эксплуатационный срок двенадцативольтовых изделий технически не грамотно. В основном потому, что в современном представлении АКБ, говоря простыми словами, может быть простой, навороченной и не очень продвинутой. Ссылаясь на виды и разновидности аккумуляторных батарей для автомобилей, мы имеем в виду обычный «гибрид», EFB, AGM и AGM TPPL. Так вот, у каждой из них свой средний срок службы:
Ссылаясь на виды и разновидности аккумуляторных батарей для автомобилей, мы имеем в виду обычный «гибрид», EFB, AGM и AGM TPPL. Так вот, у каждой из них свой средний срок службы:
- Гибридный вариант с открытым доступом к банкам (Sb/Ca): 5-6 лет.
- Та же гибридная версия, только с пластинами, окутанными конвертами (EFB): 6-7 лет.
- Гибридная модификация с абсорбированным электролитом (AGM): 8-10 лет.
- Очищенный вариант AGM (TPPL – без примеси кальция в активной массе): 10-12 лет.
Внимание! Цифры актуальны при соблюдении правил ухода за источником питания, в числе которых основным пунктом значится своевременная подзарядка от сетевого зарядника и недопущение глубокого разряда.
Такая градация по сроку годности не выдумана, а подтверждена годами. Да и теория вполне может объяснить полученные различия. Все помнят, как кальциевые батареи навсегда выходили из строя после первого глубокого разряда. В результате их вытеснили «гибриды», в легирующем пакете присадок которых наряду с кальцием присутствует серебро. Выкипание воды в таких источниках питания – явление редкое, основная проблема – осыпание активной массы и сульфатация.
В результате их вытеснили «гибриды», в легирующем пакете присадок которых наряду с кальцием присутствует серебро. Выкипание воды в таких источниках питания – явление редкое, основная проблема – осыпание активной массы и сульфатация.
С погружением пластин в конверты (EFB) ушла еще одна проблема – осыпавшаяся масса и крупные хлопья сульфатов свинца скапливаются внутри конвертов и не замыкают банки со временем. На примере AGM производители показали, как с одной единицы объема получить еще больше емкости. С появлением породистых Absorbent Glass Mat (TPPL) емкий AGM стал меньше боятся глубоких разрядов и, как результат, отслуживает солидный промежуток времени. Сульфатация – главный бич любого свинцово-кислотника, она непреодолима даже современными конструкциями АКБ.
Что говорят ГОСТы
За стартерные аккумуляторные батареи для автотехники отвечает ГОСТ Р 53165-2008. Особый интерес в этом документе могут представлять разве что нормативы испытаний. Часть из них включены «зарулевцами» в программу тестирования новых изделий. Это строгие пробы тока прокрутки в условиях холодного климата (-18°C) и суровых морозов (-29°C).
Это строгие пробы тока прокрутки в условиях холодного климата (-18°C) и суровых морозов (-29°C).
Другое дело прежний государственный стандарт ГОСТ 959-2002, который ныне утратил силу. Ценность этого документа по сравнению с настоящей версией в том, что в нем подробно раскрыты гарантии изготовителя АКБ:
- Гарантийный срок годности обслуживаемой версии (с крышечками в корпусе) – 18 месяцев с момента ввода в эксплуатацию. В эквиваленте – это 60 тыс. км пробега или 2 500 моточасов.
- Гарантия на необслуживаемую модификацию – 24 месяца с момента установки под капот, что эквивалентно 75 тыс. км или 2 500 моточасам.
Как продлить срок службы аккумуляторной батареи автомобиля
Почему-то 5-7 лет полноценной службы самого простого обслуживаемого аккумулятора на борту автомобиля приравниваются к аномальному явлению. В таких случаях принято говорить, что владельцу изделия повезло, и никак иначе. Вместе с тем, из фокуса выпадает самый главный аспект – этот самый владелец, кроме всего прочего, ухаживал за АКБ. можно констатировать факт, что широко распространённая в кругу советских автомобилистов культура обслуживания бортовых источников питания ныне находится в забвении.
можно констатировать факт, что широко распространённая в кругу советских автомобилистов культура обслуживания бортовых источников питания ныне находится в забвении.
Сухое перечисление фактов, влияющих на срок службы АКБ, можно найти в любой статье интернет-источника, принадлежащего к аккумуляторной тематике. Мы же решили привязаться к устройству источника питания, и показать, что будет, если не соблюдать то или иное правило.
Определенный тон нашей дискуссии задал главред Autobann.su Василий Теркин, держа в руках распечатку из архивного номера «За рулем». Экземплярчик, необходимо признаться, отменный – 15-й номер, год 1934. Оказывается, в довоенное время аккумулятор был на одной полке с редкими и драгоценными вещами, и продлить ему жизнь считалось делом чести.
Прочитав выдержку из журнала, мы сошлись в едином мнении. Потрясающе, практика ухода за аккумуляторными батареями, разработанная практически 100 лет назад, актуальна и сейчас. И даже более того, она применима к прогрессивным моделям из класса AGM, которые маркетологи возводят в ранг «поставил и забыл».
 Мы пройдемся по всем правилам эксплуатации и покажем, что технология обслуживания современных АКБ на фоне их прародителей стала проще, и требует минимум времени:
Мы пройдемся по всем правилам эксплуатации и покажем, что технология обслуживания современных АКБ на фоне их прародителей стала проще, и требует минимум времени:- Не допускать сильных вибраций и ударов. Дело в том, что известные всем пластины аккумулятора, расположенные в каждой из шести банок, состоят из металлической решетки и намазки (активной массы). Различные встряски – лишний повод для осыпания активной массы на дно банки, отчего теряется емкость, и многократно возрастает риск замыкания банок.
- Следить за уровнем электролита в банках. При понижении уровня электролитической жидкости открываются пластины. Сухая часть работать не будет, и засульфатируется до критической степени. Падает емкость, батарея начинает быстро заряжаться и разряжаться. Проблема на самом деле стоит остро, особенно для необслуживаемых моделей, в числе которых все прогрессивные конструкции. Суть в том, что часть воды при перезаряде и на некоторых стадиях зарядки, переходит в газ и улетучивается.
 Пластины оголяются не сразу, процесс носит накопительный характер. Со временем неплохо бы долить воду или смочить стекловолоконные маты (касается AGM), но как это сделать, если конструкция попросту герметична. Каждый находит выход по-разному: кто вскрывает крышку и проводит старомодное обслуживание банок, кто считает необходимым проверить генератор, не снимая с автомобиля с помощью мультиметра, кто покупает программируемое зарядное устройство. Так или иначе, необходимо стремиться не вгонять батарею в режим кипения, и она уж точно прослужит дольше.
Пластины оголяются не сразу, процесс носит накопительный характер. Со временем неплохо бы долить воду или смочить стекловолоконные маты (касается AGM), но как это сделать, если конструкция попросту герметична. Каждый находит выход по-разному: кто вскрывает крышку и проводит старомодное обслуживание банок, кто считает необходимым проверить генератор, не снимая с автомобиля с помощью мультиметра, кто покупает программируемое зарядное устройство. Так или иначе, необходимо стремиться не вгонять батарею в режим кипения, и она уж точно прослужит дольше.
- Избегать понижения напряжения до 10,8 В и ниже. По мере разрядки падает плотность и прогрессирует сульфатация пластин. К тому же электролит пониженной плотности замерзает уже на небольшом морозе. Допустим, AGM-конструкциям замерзание нипочем, но от сульфатации они никак не застрахованы.
- Не допускать сильного разрядного и зарядного тока. От этого коробятся пластины, осыпается активная масса со всеми вытекающими последствиями.

- Дать выход гремучим газам из внутренностей аккумулятора. В завершение зарядки ток разлагает воду на кислород и водород. Эту смесь принято называть гремучим газом. К слову, смесь эта взрывоопасная и если не найдет выхода наружу, то разорвет корпус источника питания. Исходя из этого примите к сведению следующие советы: откручивайте крышки на обслуживаемых моделях и чистите в них отверстия, очищайте клапан VRLA на необслуживаемых изделиях, не курите вблизи заряжаемой батареи, и хорошо вентилируйте помещение.
Что мы хотим порекомендовать от себя, так это две вещи:
- Заряжайте АКБ до 100% уже при 12,4 В на выводах (при температуре 20…25°C). Для этих целей необходимо выбирать не автоматические зарядные устройства или, как их принято называть в среде аккумуляторщиков, «кипятильники», а программируемые ЗУ. Важно, чтобы зарядник вел «добивку» заряда до 100% с минимальными потерями воды (в импульсном режиме). Да, с программируемым ЗУ необходимо разбираться, и хорошо знать, как заряжать необслуживаемый аккумулятор зарядным устройством, но срок службы от этого возрастает в 1,5-2 раза.

- Проводите десульфатацию, но не чаще 1 раза в год. Этот сложный процесс иначе называется «восстановление емкости батареи», и представляет собой набор контрольно-тренировочных циклов «разряд-заряд». Процесс требует углубленного знания аккумуляторной тематики и специального зарядного устройства с функцией десульфатации. Например, АКБ типа Ca/Ca нельзя разряжать даже до напряжения 10,8 В, максимум – до 11,5 В.
Итого, если не допускать глубоких разрядов, вовремя заряжать аккумуляторную батарею до 100%, не допуская кипения, периодически растворять крупные сульфаты свинца (десульфатация) с целью восстановления рабочей площади пластин до заводского состояния, следить за уровнем электролита, то изделие прослужит, что-говорится, «сверх нормы».
Если не соблюдать эти простые правила, то обычного аккумулятора хватит на две с лишним зимы. Всякие перспективные технологии никак не аннулируют общие требования к обслуживанию АКБ. В качестве аргументов служат отзывы на форумах, когда владельцы уже на четвертую зиму испытывают трудности с AGM-изделиями.
Срок годности батареи и рекомендации по хранению батареи
Оптимальные условия хранения батарей зависят от активных химических веществ, используемых в элементах. Во время хранения элементы подвержены как саморазряду, так и возможному разложению химического содержимого. Со временем растворители в электролите могут проникнуть через уплотнения, что приведет к высыханию электролита и потере его эффективности.Во всех случаях эти процессы ускоряются из-за тепла, и разумно хранить клетки в прохладной, благоприятной среде, чтобы максимально продлить срок их хранения. Перчаточный ящик автомобиля не считается подходящим местом для хранения, поскольку температура может превышать 60 ° C, что значительно сокращает срок службы аккумулятора. (См. Срок службы батареи)
Для ячеек с одинаковым номинальным химическим составом отдельные производители могут добавлять разные добавки, чтобы оптимизировать их характеристики для определенного параметра, и это может повлиять на поведение ячеек во время хранения. Можно дать некоторые общие рекомендации по хранению, но лучший совет по хранению — это ознакомиться со спецификациями и рекомендациями производителей для их продуктов. Ниже приведены некоторые общие рекомендации для некоторых распространенных химических составов клеток:
Можно дать некоторые общие рекомендации по хранению, но лучший совет по хранению — это ознакомиться со спецификациями и рекомендациями производителей для их продуктов. Ниже приведены некоторые общие рекомендации для некоторых распространенных химических составов клеток:
Первичные ячейки
Условия хранения особенно важны для первичных ячеек, потому что они не подлежат перезарядке, и поэтому любая потеря емкости является постоянной.Хотя во время хранения всегда рекомендуется сохранять клетки в прохладном состоянии, еще лучше хранить их в холодильнике. Температурный диапазон от 0 ° C до 10 ° C является предпочтительным, чтобы избежать замерзания водного электролита. При длительном хранении элементы следует хранить в паронепроницаемой упаковке, что поможет уменьшить проблему потери электролита.
Аккумуляторы
Свинцово-кислотный
Когда свинцово-кислотная батарея полностью или частично разряжена, на электродах образуется сульфат свинца. Если позволить батарее оставаться в течение длительного периода в разряженном состоянии или с очень низким уровнем заряда, сульфат свинца может образовывать большие кристаллы, которые очень трудно преобразовать обратно в свинец и серную кислоту в процессе зарядки. Образование этих кристаллов называется сульфатацией и вызывает необратимую потерю емкости аккумулятора. Поэтому, чтобы избежать этой проблемы, свинцово-кислотные батареи следует хранить только в полностью заряженном состоянии, а во время хранения следует время от времени подзаряжать их, чтобы компенсировать саморазряд элементов.
Если позволить батарее оставаться в течение длительного периода в разряженном состоянии или с очень низким уровнем заряда, сульфат свинца может образовывать большие кристаллы, которые очень трудно преобразовать обратно в свинец и серную кислоту в процессе зарядки. Образование этих кристаллов называется сульфатацией и вызывает необратимую потерю емкости аккумулятора. Поэтому, чтобы избежать этой проблемы, свинцово-кислотные батареи следует хранить только в полностью заряженном состоянии, а во время хранения следует время от времени подзаряжать их, чтобы компенсировать саморазряд элементов.
Чтобы продлить срок годности без зарядки, батареи следует хранить при температуре 10 ° C или ниже, но не допускайте замерзания электролита. Когда аккумулятор полностью заряжен, электролит представляет собой раствор серной кислоты, а температура замерзания составляет -36 ° C, но она повышается до 0 ° C в полностью разряженном состоянии, когда электролитом является просто вода.
Никель Кадмий
Никель-кадмиевые батареимогут храниться как в заряженном, так и в разряженном состоянии.Длительное хранение может ускорить саморазряд батареи и привести к дезактивации реагентов. Хотя клетки можно хранить при температурах между -20 ° C и + 45 ° C, так как почти все батареи нагреваются, что может привести к ухудшению содержания активных химикатов, поэтому лучше хранить элементы в прохладной, чистой, сухой, некоррозионной среде. После длительного хранения для восстановления полной емкости могут потребоваться два или три цикла глубокой разрядки.
Никель-металлогидрид
Никель-металлогидридные батареи имеют характеристики, аналогичные никель-кадмиевым элементам. Они могут храниться в заряженном или разряженном состоянии и иметь аналогичные требования к хранению. Поскольку у никель-металлгидридных элементов более высокая скорость саморазряда, чем у никель-кадмиевых, они будут терять больше заряда во время хранения и, скорее всего, потребуют зарядки, прежде чем их можно будет использовать.
Они могут храниться в заряженном или разряженном состоянии и иметь аналогичные требования к хранению. Поскольку у никель-металлгидридных элементов более высокая скорость саморазряда, чем у никель-кадмиевых, они будут терять больше заряда во время хранения и, скорее всего, потребуют зарядки, прежде чем их можно будет использовать.
Литий-ионный
Возможный диапазон температур хранения для литий-ионных аккумуляторов составляет от -20 ° C до 60 ° C, но для продолжительного хранения рекомендуется от -20 ° C до 25 ° C, а идеальным является 15 ° C.Элементы следует хранить с частичным зарядом от 30% до 50%. Хотя элементы могут храниться полностью разряженными, напряжение элемента не должно опускаться ниже 2,0 В на элемент, и элементы следует доливать, чтобы предотвратить чрезмерный разряд. Максимальное напряжение не должно превышать 4,1 Вольт
Если вторичные элементы должны храниться в течение длительного периода, состояние заряда следует регулярно проверять, и следует предусмотреть возможность подзарядки элементов до того, как напряжение элемента упадет ниже рекомендуемого минимума, после чего элементы будут испорчены непоправимо. (Это особенно верно для аккумуляторных блоков, которые могут иметь связанную электронику, которая увеличивает саморазряд элементов)
(Это особенно верно для аккумуляторных блоков, которые могут иметь связанную электронику, которая увеличивает саморазряд элементов)
Щелочные элементы энергии — Первичные батареи общего назначения
Характеристики
Во многих химических батареях используются щелочные электролиты, но «Щелочные батареи» обычно относятся к первичным элементам из щелочного диоксида марганца , описанным ниже.
Первичный элемент 1,5 В
Самый популярный аккумулятор общего назначения премиум-класса.
В щелочном элементе электрическая энергия в основном получается из реакции металла с кислородом.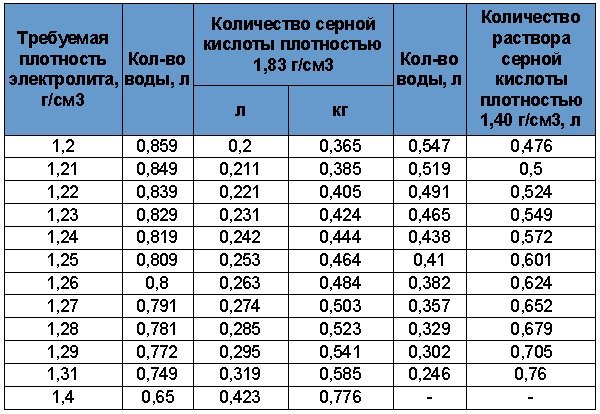
Батарея из щелочного диоксида марганца является вариантом элемента Лекланше.Как и в ячейке Лекланше, электроды выполнены из диоксида цинка и марганца, но электролитом является гидроксид калия (КОН).
Недавно стали доступны перезаряжаемые элементы, использующие этот химический состав. Известные как (RAM) перезаряжаемые щелочно-марганцевые батареи, они обладают всеми функциями и преимуществами щелочных первичных элементов, с дополнительным преимуществом, заключающимся в возможности перезарядки, но без недостатка «эффекта памяти».
Гидроксид калия (КОН)
Гидроксид калия — это электролит, который используется в большинстве первичных щелочных элементов и никелевых аккумуляторных элементах, таких как NiCad, NiMH и NiFe элементы. Он также является одним из основных ингредиентов бытового отбеливателя, очистителей сточных вод и мягкого мыла.
Преимущества
Подобен цинково-угольным элементам Лекланше и взаимозаменяем с ними, но с удвоенной плотностью энергии.
В четыре раза больше, чем у аккумуляторных никель-кадмиевых или никель-металлогидридных элементов аналогичного размера.
Срок службы в 4–9 раз больше, чем у эквивалентной ячейки Лекланше.
Постоянная производительность в широком диапазоне стоков.
Подходит для приложений с высокой скоростью слива.
Хороший срок хранения
Лучшие характеристики при низких температурах, чем угольно-цинковый.Продолжайте работать при минусовых температурах.
Меньшая утечка, чем у ячеек Лекланше
Доступен в широком диапазоне размеров, включая размеры AAA, AA, C, D и 9 Вольт.
Подходит для широкого спектра потребительских приложений
Изготовлен из нетоксичных химикатов
Недостатки
Более высокая стоимость, чем у основных конкурирующих цинк-угольных элементов Leclanché
Обычно не перезаряжается
На 25% тяжелее элементов Leclanché
Ячейки RAMимеют ограниченный срок службы около 100 циклов и доступны только в размерах AA и AAA.
Приложения
Премиум товары
Игрушки
Пульт дистанционного управления
Фонари
Частоты
Потребительские приложения
Ячейки RAM можно заменять стандартными щелочными ячейками (но не смешивать в одном приложении).
Стоимость
Низкая стоимость, но примерно на 50% выше, чем у цинк-угля, однако эти элементы более рентабельны из-за более длительного срока службы.
Щелочные элементы в основном заменили цинк-углеродные первичные элементы.
Типы и конструкция батарей для часов
На рынке представлено много различных типов батарей для часов.Полезно иметь некоторые знания о конструкции и химии основных типов, чтобы понять, почему в часах с камертонами рекомендуется использовать только элементы из оксида серебра в качестве замены ртутных элементов. Не паникуйте, здесь мы не будем вдаваться в сложные химические формулы. Это всего лишь обзор различий между типами ячеек.
Мы, любители Accutron, не только хотим, чтобы наши часы гудели и работали вовремя, но и хотим делать это, не опасаясь их повредить. Важная особенность, которая отличает батарейки для часов от других кнопочных элементов (например, батарей для слуховых аппаратов), заключается в том, что они сконструированы с очень точными допусками, чтобы минимизировать возможность утечки.
Важная особенность, которая отличает батарейки для часов от других кнопочных элементов (например, батарей для слуховых аппаратов), заключается в том, что они сконструированы с очень точными допусками, чтобы минимизировать возможность утечки.
Разнообразие доступных типов батарей объясняется не только тем, что производители аккумуляторов стараются превзойти друг друга, но и тем, что каждый тип элемента имеет особые характеристики, которые делают его пригодным только для определенных приложений. В некоторых приложениях требуется высокий ток в течение короткого времени, в других — низкий ток в течение длительного времени, в некоторых приложениях требуется дешевая альтернатива, в некоторых требуется исключительно постоянное напряжение в течение всего срока службы элемента.Ни один тип клеток не может удовлетворить всем этим требованиям, поэтому используются самые разные конструкции и химические составы клеток.
В наши дни при проектировании и производстве аккумуляторов уделяется большое внимание экологическим последствиям, связанным с утилизацией использованных аккумуляторов. Вот почему производство ртутных батарей практически остановлено. Сейчас эти элементы производит только один производитель (Varta), и они прекратят производство в 1998 году.
Вот почему производство ртутных батарей практически остановлено. Сейчас эти элементы производит только один производитель (Varta), и они прекратят производство в 1998 году.
Щелкните ссылку, чтобы перейти в интересующую вас область:
Основная конструкция ячейки
Большинство ячеек кнопочного типа построено по одной и той же базовой схеме.
1) Анодная банка — обычно содержащая металлический цинк и смесь электролита. Это формирует отрицательный полюс клетки.
2) Сепаратор — пористый материал, содержащий электролит.
3) Катодный баллон — содержащий смесь катодного материала и электролита. Это формирует положительный полюс клетки.
Верх
Сравнение энергии, запасенной различными элементами, на основе объема элемента:
Количество энергии, доступной от батареи, определяется:
1) Тип используемого химического состава элемента.
2) Количество химического материала, доступного в ячейке.
3) Температура, при которой работает ячейка.
На графике показано количество энергии, доступной от ячеек одинакового объема (размера) для данной температуры. Цинк-воздушные элементы явно имеют гораздо больше энергии. Причины указаны в разделе о воздушно-цинковых элементах ниже.
Верх
Сравнение характеристик разряда по напряжению для различных типов элементов:
На этом графике показано напряжение различных типов элементов в течение их нормального срока службы.
Для часов желательно иметь очень постоянное напряжение как можно дольше. Часы имеют довольно узкий диапазон рабочего напряжения, и чем дольше напряжение элемента остается постоянным, тем большее количество общей энергии, запасенной элементом, доступно для использования часами.
Мы заинтересованы в батареях с оксидом ртути или серебра для использования в наших Accutron.
Срок службы этих устройств находится в диапазоне:
Оксид серебра — от 1,41 до 1,62 В
Ртуть — 1. 05 до 1,36 вольт.
05 до 1,36 вольт.
Верх
Ртутные элементы
Ртутные батареи были основой батарей для часов на протяжении почти 50 лет. Эти элементы рассчитаны на 1,36 вольт. Из-за растущей обеспокоенности по поводу того, что ртуть попадает в нашу пищу, производство этих батарей практически остановлено.
ПреимуществаЧрезвычайно постоянное напряжение в течение всего срока службы. Подходит для применений с низким и периодическим высоким сливом. Длительный срок хранения — до 3-х лет.
Недостатки
Содержит ртуть, которая в определенных формах очень токсична для людей и животных.
Использует
Отлично подходит для аккумуляторов, так как они изначально были разработаны для работы с этими элементами. Используются почти во всех приложениях, требующих небольших элементов постоянного напряжения, например, в часах, слуховых аппаратах, портативных научных инструментах и т. Д.
Конструкция
A) Верх ячейки (электрод -ve)
B) Анод из порошкового цинка + гель электролита
C) Нейлоновое уплотнение
D) Электролит
E) Катод из оксида ртути и графита
F) Абсорбирующий сепаратор ткани и электролита
G) Барьерная разделительная мембрана.
H) Ячейка (+ электрод)
I) Металлическая гильза для поддержки нейлонового уплотнения
Верх
Элементы из оксида серебра
Элемент из оксида серебра действительно является идеальным преемником ртутных аккумуляторов и превосходит их по многим параметрам. Он имеет большую емкость, чем ртутные элементы для данного размера. Эти элементы рассчитаны на 1,62 вольт. Их конструкция очень похожа на ртутные элементы, главное отличие — материал катода.
ПреимуществаПостоянное напряжение в течение всего срока службы.Не содержит вредных для окружающей среды химикатов. Практически превосходит ртутные элементы по всем параметрам.
Недостатки
Примерно половина срока хранения ртутных элементов.
Использует
Основное применение — часы. Отлично подходит для аккумуляторов, которые одинаково хорошо работают с этими элементами, как и с ртутными.
Строительство
A) Верх ячейки (электрод -ve)
B) Анод из порошкового цинка + гель электролита
C) Нейлоновое уплотнение
D) Электролит
E) Катод из оксида серебра и графита
F) Абсорбирующий сепаратор ткани и электролита
G) Барьерная разделительная мембрана.
H) Ячейка (+ электрод)
I) Металлическая гильза для поддержки нейлонового уплотнения
Верх
Литиевые элементы
Литиевые элементы часто называют «монетными элементами» из-за их формы. В часах используются литиевые элементы из диоксида лития и марганца, рассчитанные на 3,0 В. Другой тип литиевых элементов, которые обычно встречаются, — это литий-тионилхлорид, рассчитанный на 3,6 или 3,7 вольт. В часах они не используются.
ПреимуществаДостаточно постоянное напряжение на протяжении большей части срока службы.Не содержит вредных для окружающей среды химикатов. Очень долгий срок хранения, до 10 лет.
Недостатки
Подходит для применений с низким или только периодическим высоким сливом.
Использует
Отлично подходит для кварцевых часов, которые потребляют очень низкий ток и только прерывистый ток, когда приводится в действие шаговый двигатель. При правильном применении может длиться 5 лет и более. Не подходит для Accutron из-за слишком высокого напряжения.
Не подходит для Accutron из-за слишком высокого напряжения.
Строительство
A) Верх ячейки (электрод с -ve)
B) Анод из лития
C) Нейлоновое уплотнение
D) Электролит в сепараторе, материале анода и катода.
E) Катод диоксида марганца
F) Абсорбирующие сепараторы, содержащие электролит
G) Ячейка (+ электрод)
Верх
Щелочные элементы
Щелочные батарейки для часов в основном используются там, где важна их стоимость. Конструкция аналогична литиевым элементам. Номинальное напряжение 1,5 В. В следующий раз, когда вы найдете бесплатные часы в своей упаковке с хлопьями для завтрака, скорее всего, они будут питаться от щелочного элемента с цинком.
Преимущества
Дешево.Экологически безопасен. Подходит для применений с низким и периодически высоким дренажем. Продержат эти дешевые кварцевые часы в течение нескольких месяцев!
Недостатки
Это примерно половина емкости элемента из оксида серебра. Напряжение не очень постоянное в течение всего срока службы. Относительно короткий срок хранения, по характеристикам схожий с угольно-цинковыми элементами, но с удвоенным запасом энергии.
Напряжение не очень постоянное в течение всего срока службы. Относительно короткий срок хранения, по характеристикам схожий с угольно-цинковыми элементами, но с удвоенным запасом энергии.
Использует
Подходит для приложений, где требуется дешевая альтернатива.Я бы не рискнул положить его в свой Accutron, даже если бы нашел подходящий.
Строительство
A) Верх ячейки (электрод с -ve)
B) Анод из цинка + гель электролита
C) Нейлоновое уплотнение
D) Электролит в сепараторе, материале анода и катода.
E) Катод диоксида марганца
F) Абсорбирующие сепараторы, содержащие электролит
G) Ячейка (+ электрод)
Верх
Цинк-воздушные элементы
Примечание: не использовать в часах!
Цинк-воздушные элементы — это , а не батарейки для часов, и они включены в этот список, потому что на первый взгляд они кажутся хорошей альтернативой элементам Mercury для наших аккумуляторов. Читайте дальше и узнайте, почему бы и нет. Цинк-воздушные элементы имеют самую высокую емкость среди всех кнопочных элементов из-за того, что большая часть объема элемента может быть занята анодным материалом (цинком), поскольку в качестве материала катода используется кислород, полученный из атмосферы. Их номинальное напряжение составляет 1,4 вольта. Они активируются путем отслаивания клеевого слоя, позволяя воздуху проникать в ячейку через небольшие вентиляционные отверстия.
Читайте дальше и узнайте, почему бы и нет. Цинк-воздушные элементы имеют самую высокую емкость среди всех кнопочных элементов из-за того, что большая часть объема элемента может быть занята анодным материалом (цинком), поскольку в качестве материала катода используется кислород, полученный из атмосферы. Их номинальное напряжение составляет 1,4 вольта. Они активируются путем отслаивания клеевого слоя, позволяя воздуху проникать в ячейку через небольшие вентиляционные отверстия.
Очень высокая производительность для своих размеров. Очень постоянное напряжение на выходе в течение большей части срока службы.Может использоваться в среднетоковых приложениях. Немного короче срок хранения, чем у ртутных элементов, когда они не активированы, но дольше, чем у щелочей и оксида серебра. Экологически безопасен.
Недостатки
Должен использоваться в приложениях, в которых аккумуляторный отсек выходит в атмосферу. Ячейки гигроскопичны, поэтому могут накапливать воду и выделять ее из атмосферы. Фактическая производительность ячейки может зависеть от относительной влажности.
Фактическая производительность ячейки может зависеть от относительной влажности.
Области применения
В основном кнопочные элементы Zinc Air используются в слуховых аппаратах.Их нельзя использовать в часах, поскольку для их работы требуется кислород воздуха, и они могут выделять воду, которая может вызывать коррозию металлических деталей. При экстремальных температурах или в случае короткого замыкания ячейки внутренние мембраны могут разорваться и выбросить жидкости и газ в атмосферу. Не использовать в часах !!!
Строительство
Верх
Вернуться на главную страницу
Батареи и элементы
Введение
В самом простом виде аккумулятор можно рассматривать как насос, который обеспечивает энергию для перемещения заряда по цепи.
Для создания разности потенциалов или электродвижущей силы (ЭДС) требуется запас энергии. Один из таких методов — аккумулятор или элемент. Термин «батарея» обычно используется для обозначения любого устройства, преобразующего химическую энергию в электрическую. Однако, строго говоря, термин «батарея» используется, когда несколько электрических элементов соединены вместе, чтобы обеспечить источник разности потенциалов в цепи. Если это всего лишь один химический источник, он называется клеткой.
Однако, строго говоря, термин «батарея» используется, когда несколько электрических элементов соединены вместе, чтобы обеспечить источник разности потенциалов в цепи. Если это всего лишь один химический источник, он называется клеткой.
История
Рисунок 1.Эксперимент на ноге лягушки Гальвани
В 1791 году Гальвани заметил, что цепь, созданная из двух разных металлов, при прикосновении к концам лапы мертвой лягушки вызывает ее подергивание. Два металла создавали электрический ток в ноге лягушки, заставляя мышцы сокращаться. Ранние батареи были усовершенствованием этого метода преобразования химической энергии в электрическую.
Первая батарея была изобретена в 1793 году Алессандро Вольта. Так же, как два разных металла, соприкасающихся с влажной кожей лягушки, вызывают электрический ток, ранние батареи увеличивали напряжение, которое можно было получить, сложив стопку дисков из серебра и цинка, зажатых между бумагой, пропитанной соленой водой. решение, как показано на рисунке 2. В честь Вольты мы используем вольт как единицу измерения разности потенциалов и ЭДС.
В честь Вольты мы используем вольт как единицу измерения разности потенциалов и ЭДС.
Рисунок 2. Батарея ячеек Вольта.
Работа от батареи
Почему это производит электричество? Поток тока можно понимать как поток ионов от металла с большей реакционной способностью к металлу с меньшей реакционной способностью. Ионы, перемещающиеся от одного электрода к другому, создают электрический заряд, который нейтрализуется потоком электронов по проводу.
Прежде чем рассматривать реакцию двух металлов, подумайте, что происходит, когда мы помещаем единственный металлический электрод в электролит.Некоторые из атомов металла в электролите переходят в раствор в виде ионов, а оставшиеся электроны создают отрицательный заряд на металле. Разделение ионов и электронов приводит к разделению заряда. Однако это накопление заряда не может продолжаться бесконечно, потому что по мере накопления отрицательного заряда в металле для положительных ионов металла становится все труднее переходить в раствор. Подобное накопление положительного заряда в электролите также предотвращает накопление заряда. Эта степень накопления заряда зависит от металла и представляет собой работу, необходимую для отделения электронов от ионов.Это известно как принцип электронейтральности
Подобное накопление положительного заряда в электролите также предотвращает накопление заряда. Эта степень накопления заряда зависит от металла и представляет собой работу, необходимую для отделения электронов от ионов.Это известно как принцип электронейтральности
Точно так же, если медную пластину поместить в водный раствор сульфата меди (II), медь также потеряет ионы. Эти реакции часто записывают как Cu | Cu +2 это полуклеточная реакция.
Цинк склонен терять ионы больше, чем медь. Когда две ячейки соединяются вместе (с использованием медной проволоки для соединения электродов и пористого барьера, который позволяет ионам проходить, известного как солевой мостик, соединяющего электролиты, накопление электронов на цинке будет проходить через провод на медь.
Ионы меди в электролите приобретают электроны и становятся атомами меди.
Таким образом, реакцию можно записать,
Zn | Zn 2+ | | Cu 2+ | Cu
Рисунок 3. Ячейка Данила
Ячейка Данила
Для продолжения реакции необходимо снять заряд. Это может быть достигнуто путем сочетания второй реакции, в которой электроны в металле превращают ионы в электролите в металл. В качестве более конкретного примера рассмотрим цинковый электрод в электролите из раствора сульфата меди (II).
Потеря электронов цинком известна как окисление. Zn (s) → Zn 2+ + 2 e — . (1)
Провод, соединяющий цинковый электрод с медным электродом, позволяет электронам течь к медному электроду. Ионы меди в растворе сульфата меди захватывают электроны и становятся атомами меди на медном электроде. Захват электронов ионами известен как уменьшение
.Cu +2 + 2e — → Cu (т). (2)
Тогда чистые реакции будут:
Zn + Cu 2+ → Cu (тв) + Zn 2+
Когда два электрода соединяются проволокой, накопленный заряд может течь, и электроны объединяются.В самых простых типах аккумуляторов есть два проводника, изготовленные из разных материалов, которые частично находятся в растворе, что позволяет электронам и ионам свободно течь, известная как электролит.
На медном электроде (катоде) кислота растворяет металлическую медь с образованием газообразного водорода H + . Реакция будет продолжаться до тех пор, пока не закончится запас цинка. Электроны с их отрицательным зарядом притягиваются к медному электроду, что вызывает протекание тока. Одна из проблем этой ячейки заключается в том, что через короткое время ток перестает течь, потому что водородные пузыри блокируют ток.
Элементы, в которых используются водные (содержащие воду) электролиты, ограничены по напряжению до менее 2 В, потому что кислород и водород в воде диссоциируют в присутствии напряжений, превышающих это напряжение. Литиевые батареи (см. Ниже), в которых используются неводные электролиты, не имеют этой проблемы и доступны с напряжением от 2,7 до 3,7 В. Однако использование неводных электролитов приводит к тому, что эти элементы имеют относительно высокий внутренний импеданс.
Серия действий
В серии активности металл отдает электроны любому другому металлу, находящемуся ниже его в серии активности. Элементы, которые получают электроны, называются отрицательными железами. Элементы, которые теряют электроны, называются положительными ионами. Любой более активный металл отдаст электроны менее активному металлу. Это поможет защитить менее активный металл от коррозии. Например, стальные корабли часто имеют цинковые стержни, прикрепленные к бортам корабля. Поскольку сталь корродирует кислородом воды и воздуха, цинк отдает электроны стали и защищает ее от коррозии.
Элементы, которые получают электроны, называются отрицательными железами. Элементы, которые теряют электроны, называются положительными ионами. Любой более активный металл отдаст электроны менее активному металлу. Это поможет защитить менее активный металл от коррозии. Например, стальные корабли часто имеют цинковые стержни, прикрепленные к бортам корабля. Поскольку сталь корродирует кислородом воды и воздуха, цинк отдает электроны стали и защищает ее от коррозии.
Батареи в цепях
Как и любой другой электрический компонент, отдельные элементы можно размещать последовательно или параллельно.Последовательно их напряжение суммируется, чтобы создать батарею с более высоким напряжением, но ток остается таким же, как в одной ячейке. Параллельно батареи имеют одинаковое напряжение, но ток суммируется, чтобы создать батарею с более высоким током.
Батареи и внутреннее сопротивление
Рисунок 4. Реальный элемент с внутренним сопротивлением.
Настоящая батарея имеет внутреннее сопротивление –, которое снижает напряжение, когда элемент подключается к нагрузке. Если вы попытаетесь пропустить через батарею слишком большой ток, внутреннее сопротивление преобразует собственную химическую потенциальную энергию батареи в тепловую.Аккумулятор нагревается, и электроны покидают отрицательный электрод с относительно небольшой энергией.
Если вы попытаетесь пропустить через батарею слишком большой ток, внутреннее сопротивление преобразует собственную химическую потенциальную энергию батареи в тепловую.Аккумулятор нагревается, и электроны покидают отрицательный электрод с относительно небольшой энергией.
Рис. 5. Ячейка с внутренним сопротивлением последовательно с нагрузкой, R .
ЭДС батареи задается параметром E и представляет собой напряжение, когда батарея разомкнута. Если бы батарея не имела внутреннего сопротивления, ток, протекающий в цепи, определялся бы законом Ома: I = E / R , где R — сопротивление нагрузки.
Внутреннее сопротивление добавляет к общему сопротивлению цепи. Если мы назовем новое общее сопротивление ячейки и нагрузки, R экв = r + R
Тогда ток равен I = E / R экв = E / ( r + R ). (3)
Поскольку R eq больше, чем R , ток, протекающий в цепи, уменьшается.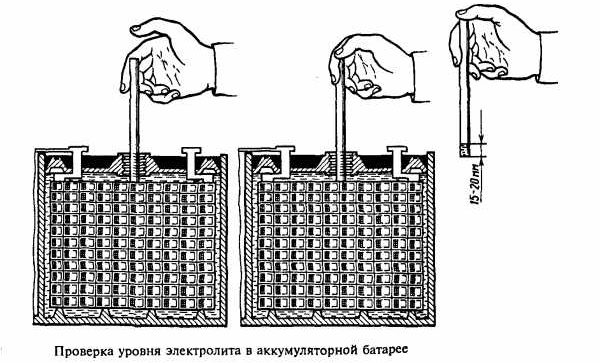 Поэтому, если мы делаем ячейку, мы хотим, чтобы внутреннее сопротивление было как можно меньше.
Поэтому, если мы делаем ячейку, мы хотим, чтобы внутреннее сопротивление было как можно меньше.
Какое напряжение на резисторе R ? Ясно, что это не то же самое, что ЭДС из-за внутреннего сопротивления. Мы знаем, что ЭДС E = Ir + IR . Мы также знаем, что напряжение на резисторе R составляет IR . Переставляя эти два уравнения, мы находим напряжение в терминах E , r и R .
В = E — Ir (4).
Это уравнение также показывает, что если мы потребляем большой ток из цепи, мы видим, что напряжение снижается.Хорошим примером этого является заведение автомобиля с включенными фарами. Когда ключ зажигания поворачивается, электрический стартер-двигатель потребляет большой ток, прежде чем он начнет вращаться. Ток для этого вырабатывается автомобильным аккумулятором, который также питает фары. В этот момент напряжение, подаваемое на фары, снижается, и огни тускнеют, когда автомобиль заводится. Они быстро снова загораются после того, как двигатель переворачивается, поскольку стартер требует меньшего тока. (Когда автомобиль заводится, стартер не потребляет ток, потому что он отключается от двигателя.)
Они быстро снова загораются после того, как двигатель переворачивается, поскольку стартер требует меньшего тока. (Когда автомобиль заводится, стартер не потребляет ток, потому что он отключается от двигателя.)
| Металл | Металлический ион | Реакционная способность |
|---|---|---|
| Литий | Li + | Наиболее реактивный |
| Калий | K + 905 905 9059 9059 905 905 905 905 Ca | |
| Натрий | K + | |
| Магний | Mg 2+ | |
| 905 905 905 905 905 905 905 905 905 Алюминий | Mn 2+ | |
| Цинк | Zn 2+ | |
| Хром | Cr 2+ , Cr 3+ 905 905 905 905 905 905 905 Железо 2+ , Fe 3+ | |
| Свинец | Pb 2+ 9059 5 | |
| Медь | Медь 2+ | |
| Ртуть | Hg 2+ | |
| Серебро | 905 905 905 905 905 905 905 905 905 905 905 ЗолотоAu + , Au 3+ | Наименее реактивная |
| Платина | Pt 2+ |
Таблица 1. Серия по реактивности металлов от наиболее реактивной до наименее реактивной.
Серия по реактивности металлов от наиболее реактивной до наименее реактивной.
Мощность и эффективность
Выходная мощность батареи равна P E = I 2 R (5)
Но из уравнения (3), I = E / R экв = E / ( r + R ), следовательно, P = E 2 R / ( р + р ) 2 (6)
Точно так же мощность, выделяемая аккумулятором в виде тепла из-за внутреннего сопротивления, составляет P r = I 2 r = E 2 r / ( r + R ) 2 (7)
КПД, η схемы — это отношение мощности, фактически производимой батареей, с ее внутренним сопротивлением к мощности, подаваемой от источника, P 0 . P 0 = I E
Вырабатываемая мощность определяется напряжением I V R , где V R — напряжение на резисторе R .
η = P E / P 0 = IV R / IE = R / ( r + R )
Чем меньше внутреннее сопротивление, тем ближе КПД η к максимальному значению 1.
Если мы построим график мощности, передаваемой на сопротивление нагрузки R , против увеличивающегося R вместе с КПД, мы обнаружим, что максимальная мощность передается батареей, когда R = r . Это очень важный результат, который находит применение во многих электрических устройствах, известный как теорема Якоби
.Передаваемая мощность и эффективность батареи при сопротивлении нагрузке.
Чтобы проверить это, мы также можем дифференцировать выражение для мощности P и R и установить его равным нулю, чтобы найти максимальное значение R.
d P / d R = -d E 2 / d R ( r + R ) -2 + d ( R + r ) — 2 / d R ( E 2 R ) = 0
E 2 / ( r + R ) 2 — 2 E 2 R / ( r + R ) 3 = 0
( r + R ) 3 — 2 R ( r + R ) 2 = 0
( R + R ) — 2 R = 0
r — R = 0 или r = R
Хотя передаваемая мощность может быть максимальной, КПД при этом проценте составляет только 50%. Чем выше сопротивление нагрузки, тем выше КПД. На практике точная нагрузка схемы зависит от области применения, хороший вольтметр имеет чрезвычайно высокое сопротивление, так что передаваемая мощность минимальна.
Чем выше сопротивление нагрузки, тем выше КПД. На практике точная нагрузка схемы зависит от области применения, хороший вольтметр имеет чрезвычайно высокое сопротивление, так что передаваемая мощность минимальна.
Типы батарей
На протяжении многих лет развитие аккумуляторных технологий было довольно медленным, но потребность в небольших более мощных батареях во многих небольших электрических устройствах, которые мы носим с собой, подтолкнула исследования к более мощным и долговечным батареям.
Цинк Углерод
Это широко известный как элемент Leclanché Cell, и, несмотря на то, что он является самым старым типом аккумулятора, он по-прежнему используется чаще всего, поскольку он очень дешев. Традиционные угольно-цинковые батареи нельзя использовать повторно, если их химическая энергия высвободилась
Цинк-угольный элемент
Щелочные элементы
Щелочная химия используется в обычных батареях Duracell и Energizer, электроды из цинка и оксида марганца с щелочным электролитом. Щелочные батареи можно использовать до 100 раз с помощью зарядного устройства правильного типа. Для зарядки этих аккумуляторов нельзя использовать обычное зарядное устройство.
Щелочные батареи можно использовать до 100 раз с помощью зарядного устройства правильного типа. Для зарядки этих аккумуляторов нельзя использовать обычное зарядное устройство.
Используемые активные вещества такие же, как и в ячейке Лекланше — цинк и диоксид марганца. Однако электролит представляет собой гидроксид калия, который обладает высокой проводимостью, что приводит к низкому внутреннему сопротивлению элемента. На этот раз цинковый анод не образует емкость; вместо этого он имеет форму порошка, что дает большую площадь поверхности.
Серебро Цинк
Легкий, но дорогой. Используется в авиационных приложениях.
Перезаряжаемые или вторичные элементы
Перезаряжаемые батареи являются перезаряжаемыми, потому что химическая реакция, которая приводит к протеканию тока, обратима при пропускании тока через батарею. На анимации показан процесс зарядки и разрядки аккумулятора. Когда аккумулятор заряжен, ток может протекать через резистивную нагрузку.
Flash-анимация 1.Перезаряжаемый аккумулятор подвергается циклам зарядки и разрядки.
Свинцово-кислотный
Свинцово-кислотные батареи используются для обеспечения большого количества тока в течение относительно короткого времени. Они состоят из пластин свинца и оксида свинца в растворе серной кислоты. Свинец соединяется с SO 4 (сульфат) с образованием PbSO4 (сульфата свинца) плюс один электрон. Диоксид свинца, ионы водорода и ионы SO 4 , а также электроны из свинцовой пластины создают PbSO 4 и воду на пластине из диоксида свинца.По мере разряда аккумулятора на обеих пластинах накапливается PbSO 4 , а в кислоте накапливается вода. Характерное напряжение составляет около 2 вольт на ячейку, поэтому, объединив шесть ячеек, вы получите аккумулятор на 12 вольт.
| полуреакция V | против SHE |
| Pb + SO 4 2- → PbSO 4 + 2 e- | .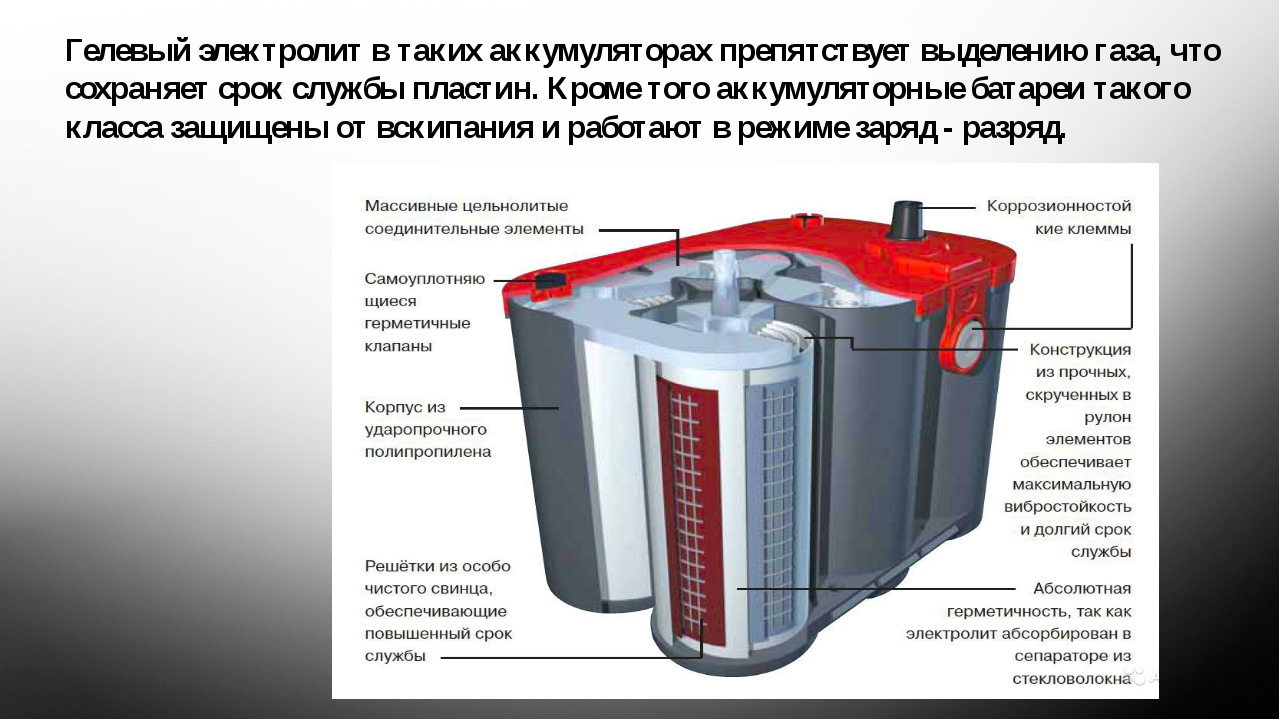 356 356 |
| PbO 2 + SO 4 2- + 4H + + 2 e- → PbSO 4 + 2H 2 O | 1.685 |
Никель-кадмий (Ni-Cad)
Никель-кадмиевые элементыявляются наиболее распространенным типом перезаряжаемых батарей. Они имеют высокую плотность энергии и ЭДС 1,2 В. Их можно перезаряжать больше раз, чем другие типы перезаряжаемых батарей, но если они полностью не разряжаются перед перезарядкой, страдают от эффекта памяти, который снижает их способность хранить заряд.
Никель-металлогидрид (Ni-Mh)
Литий-ионный (Li-Ion)
Литий — самый электроотрицательный металл в электрохимическом ряду.Он также имеет низкую плотность, поэтому он является активным материалом для анода батарей. Однако литий также очень реактивен с водными электролитами с образованием газообразного водорода. Из-за этого на разработку стабильного электролита ушло много лет. Литиевые батареи должны быть защищены от влаги и воздуха из-за реакционной способности лития. Неперезаряжаемые литиевые батареи были доступны с 1980-х годов, а перезаряжаемые литиевые батареи стали широко доступны примерно в 1995 году. Литий-ионные батареи можно заряжать от 500 до 1000 циклов.Половинки реакции:
Неперезаряжаемые литиевые батареи были доступны с 1980-х годов, а перезаряжаемые литиевые батареи стали широко доступны примерно в 1995 году. Литий-ионные батареи можно заряжать от 500 до 1000 циклов.Половинки реакции:
При выписке происходят следующие реакции:
Анод: xLi + + Mn 2 O 4 → Li x Mn 2 O 4
Катод: Li x C 6 → xLi + + 6C + xe —
В целом: Li x Mn 2 O 4 + 6C → Li x C 6 + Mn 2 O 4
Литий-полимерный (Li-poly)
В литий-полимерных батареях используется твердый полимерный электролит.
Ржавчина
Коррозия чугуна и стали из-за ржавчины ежегодно вызывает миллионы фунтов ущерба. Рустиинг — это окисление металла с образованием оксида металла. Ржавчина не прилипает прочно к поверхности металла, что позволяет ему окисляться. Оксид вызывает повреждение поверхности металла, известное как точечная коррозия, что со временем снижает структурную целостность металла.
Причем тут батарейки? Ржавчина — это химический процесс, который происходит, когда железо или сталь подвергаются воздействию влажного воздуха, он реагирует с кислородом воздуха с образованием оксида железа (III).Ранее мы видели, как электричество вырабатывается в процессе окисления и восстановления. Образование ржавчины может происходить на некотором расстоянии от фактической точечной коррозии или эрозии железа, как показано ниже. Это возможно, потому что электроны, образовавшиеся в результате начального окисления железа, могут проходить через металл, а ионы железа могут диффундировать через слой воды в другую точку на поверхности металла, где доступен кислород. Результатом этого процесса является электрохимическая ячейка, в которой железо служит анодом, газообразный кислород — катодом, а водный раствор ионов служит «солевым мостиком», как показано ниже.
Ржавление железа каплей воды.
Fe → Fe +2 + 2e — и Fe → Fe +3 + e — в аноде
Количество воды в комплексе с оксидом железа (III) (оксид железа) варьируется, как указано буквой «X». Количество воды также определяет цвет ржавчины, который может варьироваться от черного до желтого и оранжево-коричневого. Образование ржавчины — очень сложный процесс, который, как считается, начинается с окисления железа до ионов двухвалентного железа (железо «+2»).
Fe → Fe +2 + 2 e —
И вода, и кислород необходимы для следующей последовательности реакций. Ионы железа (+2) дополнительно окисляются с образованием ионов трехвалентного железа (железа «+3»).
Fe +2 → Fe +3 + 1 e —
Электроны, полученные на обеих стадиях окисления, используются для восстановления кислорода, как показано.
O 2 (г) + 2 H 2 O + 4e — → 4 OH —
Ионы трехвалентного железа затем соединяются с кислородом с образованием оксида трехвалентного железа [оксида железа (III)], который затем гидратируется с помощью различных количеств воды.Общее уравнение образования ржавчины можно записать как:
Другие металлы, такие как алюминий, образуют оксидный слой, когда они вступают в контакт с кислородом воздуха, но этот оксидный слой очень прочно связывается с поверхностью алюминия, предотвращая дальнейшее окисление. Однако алюминий может за очень короткое время заржаветь, если на поверхность нанести тонкий слой ртути. Ртуть легко соединяется с алюминием, образуя ртуть-алюминиевую амальгаму, когда два чистых металла вступают в контакт.Когда амальгама подвергается воздействию воздуха, алюминий окисляется, оставляя ртуть. Оксид отслаивается, обнажая больше амальгамы ртути, которая повторяет процесс, таким образом, небольшое количество ртути может со временем ржаветь большое количество алюминия, постепенно образуя амальгаму и отказываясь от алюминия как оксида. По этой причине использование ртути в самолетах запрещено.
Топливные элементы
Водородные топливные элементы — это относительно новая технология, которая использует водород и кислород и преобразует их в электричество с помощью катализатора.

 Этому пределу плотности соответствует концентрация h3SO4 27−40%.
Этому пределу плотности соответствует концентрация h3SO4 27−40%.

 Следует получить как минимум такое количество циклов, которое не приведет к снижению емкости ниже 80% от ее номинальной величины. Соответствующая методика изложена в DIN 43539, часть 3.
Следует получить как минимум такое количество циклов, которое не приведет к снижению емкости ниже 80% от ее номинальной величины. Соответствующая методика изложена в DIN 43539, часть 3.
 удалить крышку батареи. При этом пробки остаются закрытыми.
удалить крышку батареи. При этом пробки остаются закрытыми.

 Пластины оголяются не сразу, процесс носит накопительный характер. Со временем неплохо бы долить воду или смочить стекловолоконные маты (касается AGM), но как это сделать, если конструкция попросту герметична. Каждый находит выход по-разному: кто вскрывает крышку и проводит старомодное обслуживание банок, кто считает необходимым проверить генератор, не снимая с автомобиля с помощью мультиметра, кто покупает программируемое зарядное устройство. Так или иначе, необходимо стремиться не вгонять батарею в режим кипения, и она уж точно прослужит дольше.
Пластины оголяются не сразу, процесс носит накопительный характер. Со временем неплохо бы долить воду или смочить стекловолоконные маты (касается AGM), но как это сделать, если конструкция попросту герметична. Каждый находит выход по-разному: кто вскрывает крышку и проводит старомодное обслуживание банок, кто считает необходимым проверить генератор, не снимая с автомобиля с помощью мультиметра, кто покупает программируемое зарядное устройство. Так или иначе, необходимо стремиться не вгонять батарею в режим кипения, и она уж точно прослужит дольше.
