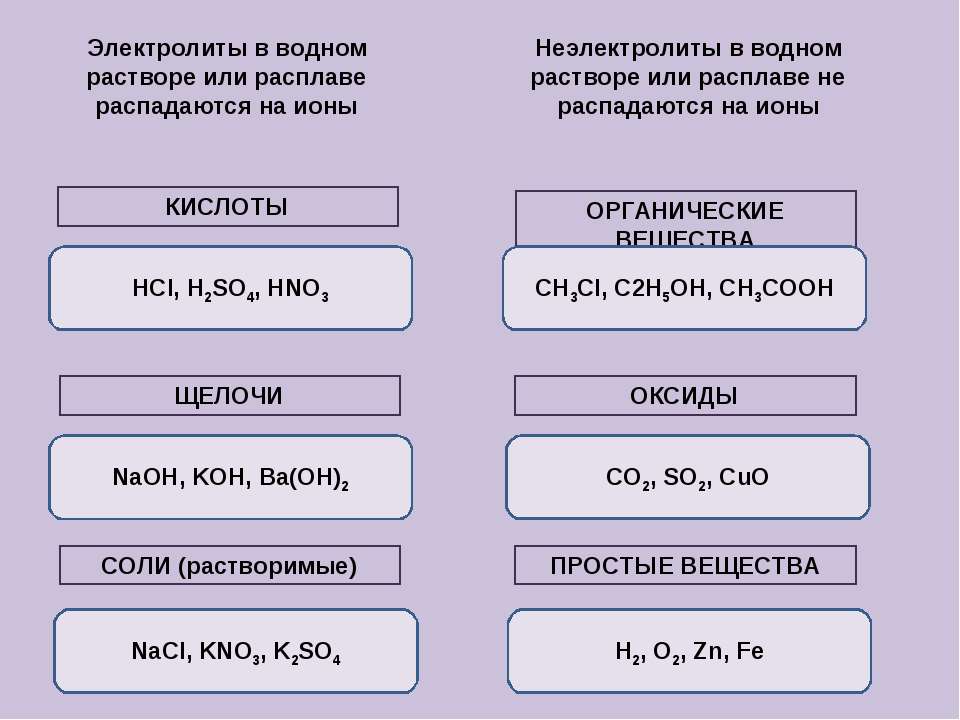
Электролиты и неэлектролиты
1. Электролиты — это вещества, растворы или расплавы которых проводят электрический ток.
2. К электролитам относятся щелочи, растворимые соли и кислоты.
3. В водных растворах электролиты распадаются на ионы.
4. Неэлектролиты — вещества, растворы которых не проводят электрический ток.
5. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др.
6. Слабые кислоты: H2S, H2CO3, HF, H2SO3, H2SiO3, органические кислоты
Давайте порассуждаем вместе
1. К электролитам относится
1) метанол
2) железо
3) хлорид железа (II)
4) оксид железа (III)
Ответ: электролитом является хлорид железа (II) — растворимая соль
2. К электролитам относится
К электролитам относится
1) фосфор
2) сера
3) глюкоза
4) уксусная кислота
Ответ: электролитом является уксксная кислота — т.к. это растворимая кислота.
3. К слабым электролитам не относится
1) соляная кислота
2) сероводород
3) угольная кислота
4) уксусная кислота
Ответ: соляная кислота не относится к слабым электролитам, это сильный электролит
4. К сильным электролитам не относится
1) бромоводород2) хлороводород
3) сероводород
4) серная кислота
Ответ: сероводород — это слабый электролит, не относится к сильным электролитам
5. Сильным электролитом является
Сильным электролитом является
1) угольная кислота
2) серная кислота
3) сахароза
4) метан
Ответ: серная кислота — сильный электролит
6. Не является электролитом
1) поваренная соль
2) щелочь
3) азотная кислота
4) спирт
Ответ: спирт не является электролитом
7. К электролитам относится
1) C2H5OH
2) C2H4
3) Ca(OH)2
4) CO
Ответ: Ca(OH)2 — малорастворимое основание, значит относится к электролитам
| 1. | Электролиты | 1 вид — рецептивный | лёгкое | 1 Б. | Знать определение электролитов, вещества-электролиты. |
| 2. | Неэлектролиты | 1 вид — рецептивный | лёгкое |
1 Б.
|
Знать определение неэлектролитов, вещества-неэлектролиты. |
| 3. | Сильные электролиты | 1 вид — рецептивный | лёгкое | 1 Б. | Знать определение сильных электролитов, узнавать вещества — сильные электролиты. |
4.
|
Слабые электролиты | 1 вид — рецептивный | лёгкое | 1 Б. | Знать определение слабых электролитов, узнавать вещества — слабые электролиты. |
| 5. | Примеры сильных электролитов | 2 вид — интерпретация | среднее |
2 Б. |
Знать примеры веществ — сильных электролитов. |
| 6. | Примеры слабых электролитов | 2 вид — интерпретация | среднее | 2 Б. | Знать примеры веществ — слабых электролитов. |
| 7. | Электролитическая диссоциация | 2 вид — интерпретация | среднее |
3 Б.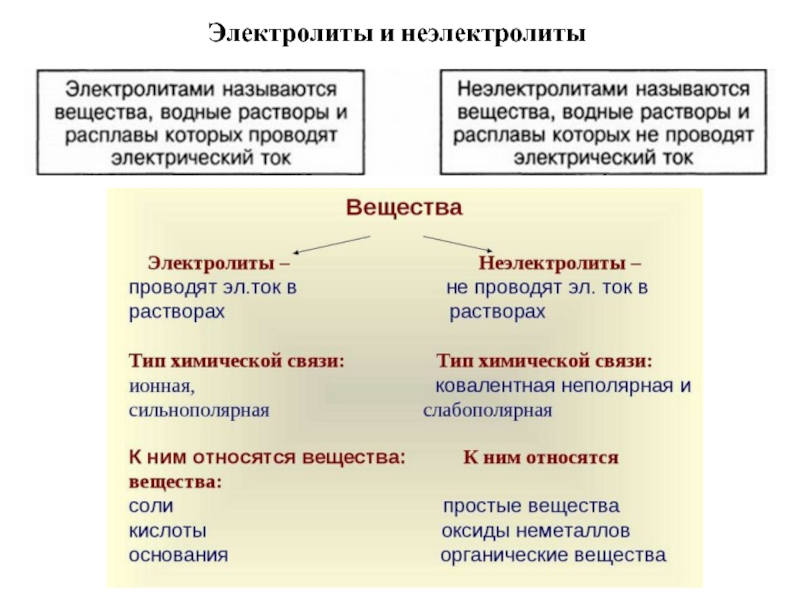
|
Понимать суть электролитической диссоциации и причину электрической проводимости растворов электролитов. |
| 8. | Степень диссоциации | 2 вид — интерпретация | среднее | 3 Б. | Уметь характеризовать степень диссоциации электролитов на конкретных примерах. |
Растворы электролитов.
 Ионно–молекулярные уравнения
Ионно–молекулярные уравненияЭлектролиты
При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Те соединения, водные растворы которых способны проводить электрический ток называются электролитами.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
- Кислоты.
 К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами. - Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be) относятся к сильным электролитам. Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений — сильные электролиты. Исключения составляют, в основном, соли тяжелых металлов.
Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Сущность теории электролитической диссоциации
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации электролита зависит от:
- природы самого электролита
- природы растворителя
- концентрации электролита
- температуры.
Степень диссоциации
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
α = n/N
- Степень диссоциации равна 0 α = 0 означает, что диссоциация отсутствует.

- При полной диссоциации электролита степень диссоциации равна 1 α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на:
- сильные (α > 0,7),
- средней силы ( 0,3 > α > 0,7),
- слабые (α < 0,3 ).
Константа диссоциации
Более точно процесс диссоциации электролита характеризует константа диссоциации, не зависящая от концентрации раствора. Если представить процесс диссоциации электролита в общем виде:
Aa Bb ↔ aA— + bB+
K = [A—]a·[B+]b/[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α2C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α2C
Отсюда нетрудно найти степень диссоциации
α = (K/C)1/2
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H+ + Cl— +Na+ + OH— = Na+ + Cl— + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H+ + OH— = HOH
Мы видим, что процесс нейтрализации сводится к соединению H+ и OH— и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
| Молекулярное уравнение | AgNO3 + HI →AgI↓ + HNO3 |
| Полное ионное уравнение | Ag+ + NO3— + H+ + I— →AgI↓ + H+ + NO3— |
| Сокращенное ионное уравнение | Ag+ + I— →AgI↓ |
Процесс осаждения сводится к взаимодействию только Ag+ и I— и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
| Молекулярное уравнение | Na2SO3 + 2HI → 2NaI + SO2↑ + H2O |
| Полное ионное уравнение | 2Na+ + SO32- + 2H+ + 2I— → 2Na+ + 2I— + SO2↑ + H2O |
| Сокращенное ионное уравнение | SO32- + 2H+ → SO2↑ + H2O |
Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
| Молекулярное уравнение | CaCl2 + 2NaI = 2NaCl +CaI2 |
| Полное ионное уравнение | Ca2+ + Cl— + 2Na+ + I— = 2Na+ + Cl— + Ca2++ 2I— |
| Сокращенное ионное уравнение | отсутствует |
Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита.
 В качестве неэлектролита может выступать вода.
В качестве неэлектролита может выступать вода. - Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Больше примеров приведено в разделе Задачи к разделу растворы электролитов
Также для тренировки, рекомендуем пройти тест Задания 14. Электролиты и неэлектролиты. Катионы и анионы
Электролиты и неэлектролиты в химии
Содержание:
Электролиты и неэлектролиты:
Еще в начале XIX в. ученые сделали важное наблюдение: электрический ток могут проводить не только металлы, но и растворы многих веществ, например уксусной кислоты, поваренной соли и др.
Электропроводность раствора можно установить с помощью прибора, изображенного на рисунке 14.
При погружении электродов в дистиллированную воду лампочка не загорается. Чистая вода не проводит электрический ток (рис. 15). Не проводит ток и сухая поваренная соль NaCl, если в нее погрузить электроды. Водный раствор этой же соли проводит электрический ток. Можно сделать вывод, что в растворе имеются носители электрического тока — заряженные частицы (ионы). Точно так же ведут себя в растворах и другие соли, а также щёлочи и кислоты. Безводные
кислоты — очень плохие проводники электрического тока, но водные растворы многих кислот являются хорошими проводниками. Электропроводными являются также расплавы ионных соединений — солей и щелочей.
Исследуем электропроводность растворов и таких веществ, как сахароза, глюкоза, спирт. Мы видим, что лампочка в приборе не загорается.
Результаты испытаний электропроводности веществ в исходном (твердом, жидком или газообразном) состоянии и их водных растворов отражены в таблице 10.
Таблица10. Электропроводность некоторых веществ и их растворов
Известный английский физик Майкл Фарадей предложил разделить все вещества в зависимости от их способности проводить ток в растворенном или расплавленном состоянии на электролиты и неэлектролиты (рис. 16). Термин «электролит» происходит от греческого слова литос — растворенный (разложенный).
Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К электролитам относятся соединения с ионным типом связи. Это соли и др.) и основания Кристаллы этих веществ построены из ионов, закономерно расположенных в узлах кристаллической решетки и удерживаемых в таком положении электростатическими силами.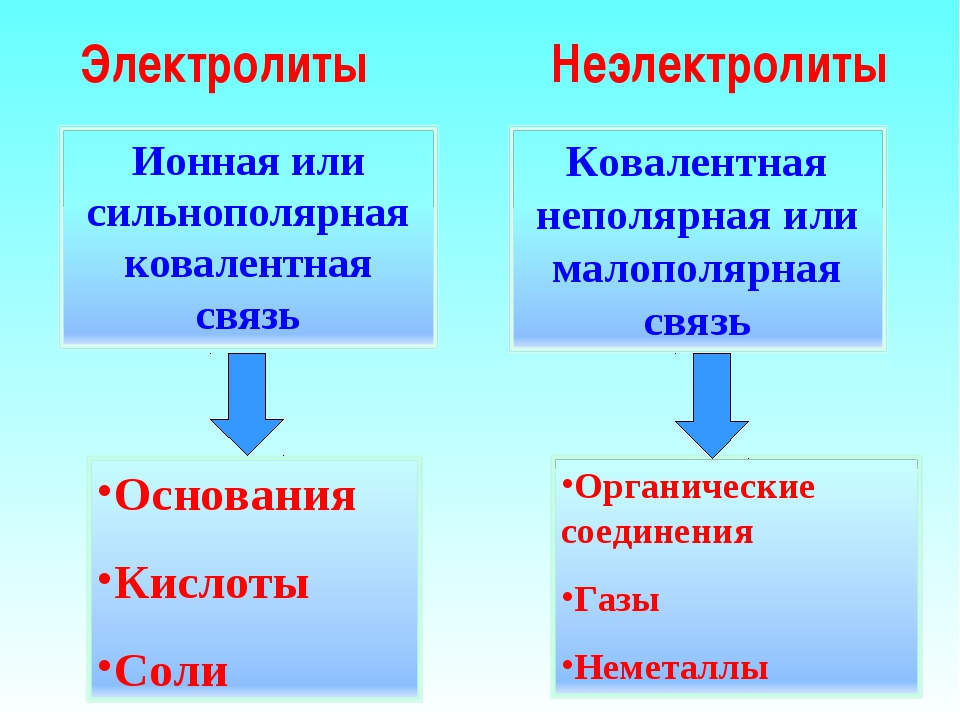 В процессе растворения этих электролитов в воде образующие их ионы переходят в раствор.
В процессе растворения этих электролитов в воде образующие их ионы переходят в раствор.
Электролитами являются и многие кислоты — вещества, образованные молекулами с ковалентными полярными связями и др.).
Вещества, водные растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Неэлектролитами является большинство органических веществ, таких как сахароза, спирт, глицерин, простые вещества неметаллов и др. Они существуют в виде неполярных или малополярных молекул, которые при растворении в воде распределяются между ее молекулами.
По способности проводить электрический ток в растворах и расплавах вещества делятся на электролиты и неэлектролиты.
Электролиты — это вещества, водные растворы или расплавы которых проводят электрический ток.
Электролитами являются ионные соединения (основания, соли) и большинство кислот.
Электролитическая диссоциация веществПочему растворы и расплавы электролитов проводят электрический ток? Для ответа на этот вопрос шведский ученый Сванте Аррениус в 1887 г. детально изучил поведение веществ в водных растворах и выдвинул теорию, которая получила название теории электролитической диссоциации. Термин «диссоциация» происходит от латинского слова dissociatio — разъединение, распад.
детально изучил поведение веществ в водных растворах и выдвинул теорию, которая получила название теории электролитической диссоциации. Термин «диссоциация» происходит от латинского слова dissociatio — разъединение, распад.
Электрический ток — это направленное движение заряженных частиц. Какие же частицы являются носителями электрического тока в растворах? В результате многочисленных экспериментов Аррениус установил, что растворы электролитов содержат больше частиц, чем их было в исходном веществе. Например, если в воде растворить хлороводород химическим количеством 1 моль, в растворе суммарное число частиц будет 2 моль, а 1 моль хлорида алюминия образует 4 моль частиц. Учитывая, что кристаллы хлорида алюминия имеют ионное строение, мы можем утверждать, что ионы алюминия и хлорид-ионы в воде переходят в раствор. Объяснения этих наблюдений явились основой теории электролитической диссоциации. Согласно этой теории, при растворении в воде или при расплавлении электролиты распадаются (диссоциируют) на ионы — положительно и отрицательно заряженные частицы.
Согласно этой теории, при растворении в воде или при расплавлении электролиты распадаются (диссоциируют) на ионы — положительно и отрицательно заряженные частицы.
Электролитическая диссоциация — это распад электролитов на ионы в водных растворах или расплавах.
При диссоциации электролитов образуются как простые ионы, состоящие из одного атома и др.), так и сложные ионы, состоящие из нескольких атомов и др.).
Обратите внимание:
- заряд иона и степень окисления атома записываются по-разному!
При обозначении заряда иона справа вверху от его формулы сначала записывают цифру, а потом знак + или –. При обозначении же степени окисления атома, как вы уже знаете, над символом элемента сначала записывается знак + или –, а потом — число.
Для обозначения заряженных частиц Аррениус использовал термин «ион», предложенный ранее М. Фарадеем. Слово «ион» в переводе с греческого означает «движущийся, идущий, странствующий». В растворах ионы непрерывно перемещаются («странствуют») в различных направлениях.
В растворах ионы непрерывно перемещаются («странствуют») в различных направлениях.
Главной причиной электролитической диссоциации в водных растворах является взаимодействие электролитов с молекулами воды. Такое взаимодействие называется гидратацией.
При погружении кристалла ионного соединения в воду полярные молекулы воды (диполи) притягиваются к ионам, находящимся на поверхности кристалла: отрицательными полюсами — к положительно заряженным ионам, а положительными полюсами — к отрицательно заряженным. Под действием молекул воды ионы отрываются от кристалла и переходят в раствор. При этом каждый отдельный ион оказывается окруженным диполями воды (рис. 17). Такие ионы называются гидратированными ионами.
Процесс электролитической диссоциации изображают химическим уравнением, в котором вместо знака равенства пишут либо одну, либо две противоположно направленные стрелки Обычно в уравнениях электролитической диссоциации не указывают формулы молекул воды, связанных с ионами в растворе:
При составлении уравнений электролитической диссоциации руководствуются следующими правилами. В левой части уравнения записывают формулу вещества-электролита, а в правой — формулы ионов, на которые распадается электролит. Их число указывают с помощью коэффициентов:
Обратите внимание: сложные ионы, например в процессе диссоциации не разрушаются!
В молекулах с ковалентной связью ионов нет. Если в веществе ковалентная связь является малополярной, то при его растворении в воде разрываются только слабые связи между молекулами, а сами молекулы вещества остаются целыми, т. е. не распадаются на ионы и равномерно распределяются по всему объему раствора. Но что происходит при растворении в воде веществ с сильно полярной ковалентной связью, например газа хлороводорода HCl?
Когда полярная молекула хлороводорода попадает в воду, к той ее части, где сосредоточен положительный заряд, молекулы воды притягиваются своими отрицательными полюсами. К той части молекулы HCl, которая заряжена отрицательно, молекулы воды притягиваются положительными полюсами. В результате под действием диполей воды ковалентная полярная связь в молекуле хлороводорода разрывается с образованием гидратированных ионов водорода и хлора, которые переходят в раствор (рис. 18):
При разрыве химической связи электронная пара остается у отрицательно заряженного иона хлора. В растворе вместо каждой нейтральной молекулы HCl оказываются по два гидратированных иона: положительно заряженный ион водорода (H+ ) и отрицательно заряженный ион хлора (Cl— ). При этом общий заряд положительных ионов равен общему заряду отрицательных ионов.
Диссоциация молекул других кислот (иодоводородной, азотной, серной и др.) протекает в водных растворах сходным образом.
Если атомы в молекулах растворяемых веществ связаны ковалентной малополярной или неполярной связью, то эти вещества в водных растворах не распадаются на ионы. Поэтому такие вещества являются неэлектролитами.
Следовательно, электролитами могут быть только вещества с ионной и ковалентной полярной связью.
- При растворении в воде электролиты диссоциируют на отдельные ионы, которые в растворе окружены молекулами воды (гидратированы).
- Распад электролитов на ионы в водном растворе или расплаве называется электролитической диссоциацией.
- Главной причиной электролитической диссоциации в растворе является взаимодействие электролитов с молекулами воды.
Ионы, образующиеся в процессе диссоциации электролитов в водных растворах, отличаются по своим свойствам от соответствующих нейтральных атомов и молекул.
Как вы уже знаете, при растворении поваренной соли в воде, содержащиеся в ее кристаллах ионы натрия и хлора переходят в раствор:
Сравним свойства атома и иона натрия. Общим, одинаковым в этих частицах является заряд ядра, равный 11+. Отличаются же они строением электронных оболочек, а следовательно, и свойствами (табл. 11).
Таблица 11. Отличия атомов натрия от ионов
Высокая химическая активность натрия обусловлена тем, что у его атома на внешнем электронном слое находится всего один электрон. При взаимодействии с другими атомами атом натрия отдает этот электрон и превращается в гораздо более устойчивую частицу — ион Na+ (рис. 19). Так, атомы натрия взаимодействуют с водой, вытесняя из нее водород, а при растворении поваренной соли в воде водород не выделяется.
Строение и, следовательно, свойства атомов хлора Cl также будут отличаться от свойств ионов хлора Cl— (табл. 12).
Таблица 12. Отличия атомов хлора от ионов
Химическая активность атома хлора связана с нехваткой одного электрона на внешнем электронном слое для его завершения (рис. 20). Этот электрон атом хлора присоединяет при взаимодействии с атомами металлов, превращаясь при этом в устойчивый ион хлора
Атомы хлора Cl могут соединяться друг с другом ковалентной неполярной связью, образуя молекулу . Свободный хлор — ядовитый газ с зеленоватой окраской и характерным запахом, а ионы хлора бесцветны и не имеют запаха. Раствор поваренной соли, как и сама соль NaCl, широко используется при приготовлении пищи, не причиняя вреда организму.
Аналогичным образом различаются свойства атомов водорода H, молекулярного водорода и ионов водорода Молекулярный водород — это газ, который почти не растворяется в воде и горит на воздухе. Ионы водорода , напротив, в воде могут находиться в очень большом количестве.
Таким образом, различия в свойствах атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
В растворе ионы находятся в хаотическом движении. Но если опустить в раствор электролита электроды и подать на них электрическое напряжение, то ионы приобретают направленное движение: положительно заряженные ионы перемещаются к катоду (отрицательно заряженному электроду), а отрицательно заряженные ионы — к аноду (положительно заряженному электроду) (рис. 21). Поэтому положительно заряженные ионы получили название катионы, а отрицательно заряженные — анионы. Следы движения окрашенных ионов (например, можно наблюдать на влажной фильтровальной бумаге, если на нее поместить крупинки соли
Свойства ионов в растворах во многом отличаются и от свойств этих же ионов в безводных веществах. Так, например, катионы меди в сульфате меди(II) практически бесцветны, а раствор этой соли имеет голубой цвет (рис. 22). Это обусловлено, прежде всего, гидратацией катионов меди , т. е. их взаимодействием с молекулами воды.
В состав большинства минеральных вод, которые продаются в наших магазинах, входят катионы натрия, кальция, магния, хлорид-анионы, сульфат-анионы, гидрокарбонат-анионы.
- Различия в свойствах атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
- Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
Все ли электролиты диссоциируют одинаково? Каждое вещество обладает определенными свойствами и, возможно, процесс диссоциации разных веществ протекает в различной степени. Действительно, если сравнить электропроводность растворов хлороводородной и угольной кислот, то оказывается, что при их одинаковой молярной концентрации раствор хлороводорода обладает большей электропроводностью. Следовательно, в растворе хлороводородной кислоты больше заряженных частиц (ионов), т. е. молекулы НСl диссоциируют лучше.
В зависимости от способности к диссоциации все электролиты условно делят на две группы — сильные и слабые. К сильным электролитам относятся вещества, которые при растворении практически полностью диссоциируют на ионы. Это почти все соли, щёлочи и др.), кислоты и др.), которые так и называются — сильные кислоты (рис. 23, вверху). Диссоциацию таких электролитов записывают в виде уравнения со стрелкой в одном направлении:
При растворении ионного соединения его кристаллическая структура разрушается под действием молекул воды, в результате чего в растворе образуются гидратированные ионы (см. рис. 17). Поэтому все растворимые ионные соединения в растворах находятся в виде ионов.
Вещества молекулярного строения с ковалентной полярной связью также способны распадаться на ионы в водных растворах (см. рис. 18). Полярные молекулы воды усиливают полярность молекулы электролита, превращая ее практически в ионную структуру с последующим распадом на ионы. Диссоциация полярных молекул может быть полной или частичной в зависимости от степени полярности связей в молекуле.
К слабым электролитам относятся вещества, при растворении диссоциирующие на ионы в незначительной степени. Это, например, такие кислоты как (азотистая кислота), все органические кислоты. В водных растворах они диссоциируют обратимо. Это означает, что одновременно в растворе осуществляются два противоположных процесса — распад молекул на ионы (диссоциация) и объединение ионов в молекулы (ассоциация). Поэтому в растворах слабых электролитов наряду с ионами содержатся недиссоциированные молекулы. Диссоциацию таких электролитов, например азотистой кислоты отображают в виде уравнения с двумя противоположно направленными стрелками (см. рис. 23, внизу):
Разберем более подробно процесс диссоциации слабой двухосновной угольной кислоты Как и азотистая кислота, она диссоциирует не полностью и обратимо. От молекулы ионы водорода отщепляются не одновременно, как в случае сильных кислот, а последовательно, или ступенчато. На первой ступени диссоциации образуются катионы водорода и анионы (рис. 24):
Анионы − называются гидрокарбонат-ионами. Соединяясь с ионами , они превращаются в недиссоциированные молекулы При этом, как и в случае азотистой кислоты, процессы диссоциации и ассоциации протекают одновременно, и в растворе содержатся как ионы, так и недиссоциированные молекулы кислоты.
На второй ступени гидрокарбонат-ионы обратимо диссоциируют с образованием катионов водорода и карбонат-анионов (рис. 25):
Как правило, на второй ступени диссоциация происходит гораздо слабее.
Кроме слабых кислот, к слабым электролитам относятся также малорастворимые основания, например раствор аммиака в воде.
Чистая вода является очень слабым электролитом и незначительно диссоциирует на ионы водорода и гидроксид-ионы:
Содержание ионов и в воде чрезвычайно мало, поэтому диссоциацией воды мы обычно пренебрегаем, а среда дистиллированной воды является нейтральной.
С количественными характеристиками способности веществ к диссоциации вы познакомитесь при дальнейшем изучении химии.
- По способности диссоциировать в водных растворах электролиты делятся на сильные и слабые.
- Растворимые вещества с ионной и ковалентной сильно полярной связью относятся к сильным электролитам.
- Растворимые вещества с ковалентной малополярной связью относятся к слабым электролитам. В их растворах наряду с ионами присутствуют недиссоциированные молекулы.
Вы уже знаете, что химические вещества делятся на классы — оксиды, кислоты, основания, соли. Как ведут себя в водных растворах вещества этих классов?
Вспомните отношение оксидов к воде. Основные оксиды активных металлов взаимодействуют с водой с образованием щелочей. Кислотные оксиды в результате растворения в воде образуют кислоты. Таким образом, основные и кислотные оксиды не являются электролитами и при контакте с водой не распадаются на ионы, а реагируют с ней. Электролитами являются кислоты, щёлочи и соли.
Водные растворы кислот имеют некоторые общие свойства. Для них характерны кислый вкус, способность окрашивать лакмус в красный цвет, взаимодействовать с некоторыми металлами с выделением водорода, а также с основными оксидами и основаниями. Точно также некоторые общие свойства имеют водные растворы всех щелочей: они мыльные на ощупь, окрашивают лакмус в синий цвет, способны реагировать с кислотными оксидами, кислотами. Водные растворы солей одной и той же кислоты или солей одного и того же металла также имеют общность свойств. Основная причина общности свойств растворов таких электролитов определяется однотипностью процессов их диссоциации.
Диссоциация кислотКислоты диссоциируют в водных растворах на ионы водорода H+ и анион кислотного остатка, например:
Как вы уже знаете, молекулы кислот могут содержать разное количество атомов водорода. Число атомов водорода в молекуле кислоты, способное замещаться атомами металла с образованием соли, определяет основность кислоты. Так, например, — одноосновные, и — двухосновные, — трехосновная кислоты.
Многоосновные сильные кислоты диссоциируют ступенчато. Однако, поскольку при этом атомы водорода, превращаясь в ионы, уходят в раствор практически одновременно, диссоциацию таких кислот записывают одним уравнением:
Диссоциация многоосновных слабых кислот протекает сложнее, чем сильных. Например, слабые двухосновные кислоты частично диссоциируют только по первой ступени: Диссоциация по второй ступенипрактически невозможна. Поэтому в водных растворах слабых кислот наряду с ионами водорода и анионами кислотного остатка присутствуют недиссоциированные молекулы. Свойства таких растворов, например специфический запах сероводородной кислоты связаны с наличием в растворе молекул, которые могут испаряться из раствора.
Таким образом, в растворах всех кислот содержатся ионы водорода которые и обусловливают общие свойства водных растворов кислот: кислый вкус, способность изменять окраску индикаторов, взаимодействовать с другими веществами. Растворы, которые содержат ионы водорода, принято называть кислыми или говорить, что они имеют кислотный характер (кислую среду). Чем больше ионов водорода находится в растворе, тем выше кислотность среды.
У газа хлороводорода HCl, так же как и у безводной серной кислоты, кислотные свойства отсутствуют. Эти свойства проявляются только в водных растворах указанных веществ, так как в процессе их диссоциации образуются ионы водорода, которые и определяют кислотный характер растворов. Следовательно, можно дать такое определение кислот.
Кислоты — это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Первое определение кислот в химии было предложено Р. Бойлем (1627—1691). Кислотами он называл вещества, которые реагировали с содой с выделением газа и окрашивали фиолетовые цветки фиалки в красный цвет. Позже он исследовал отвары, спиртовые вытяжки, соки других растений и установил, что щёлочи также меняют их окраску.
Диссоциация основанийРастворимые в воде основания называются щелочами. В результате диссоциации щелочей образуются катионы металлов и гидроксид-ионы:
Мыльность растворов, способность окрашивать индикаторы, их едкое действие — результат присутствия в водном растворе гидроксид-ионов Поэтому можно дать такое определение оснований.
Основания — это электролиты, при диссоциации которых в водных растворах в качестве анионов образуются только гидроксид-ионы.
Вместе с тем и кислоты, и основания обладают индивидуальными свойствами, зависящими от природы аниона или катиона соответственно. Некоторые свойства серной кислоты и ее солей (например, образование осадка с раствором хлорида бария) обусловлены свойствами ее аниона (рис. 26).
Диссоциация солейСоли — это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков:
Свойства растворов солей также обусловлены свойствами всех ионов, которые образуются в процессе диссоциации.
Раствор, в котором находятся одинаковые количества ионов как в чистой воде, называют нейтральным. Если в растворе содержится больше ионов такой раствор называют кислым, а раствор, в котором больше ионов , — щелочным (табл. 13).
Таблица 13. Характеристика среды растворов
Определить среду раствора — это значит обнаружить в нем ионы и Это можно сделать с помощью уже известных вам веществ — индикаторов (рис. 27). Индикаторы — органические вещества, некоторые из которых встречаются в живой природе. В лаборатории чаще всего применяются уже известные вам лакмус, метилоранж, фенолфталеин, универсальный индикатор.
Лабораторный опыт 1
Обнаружение катионов водорода и гидроксид-анионов в растворах
Обнаружение ионов, обеспечивающих кислую или щелочную среду в растворах, имеет большое значение в лабораторной практике, медицине, промышленности и в быту.
1. Обратите внимание на окраску лакмуса, метилоранжа и фенолфталеина в нейтральной среде — водном растворе или на полоске универсальной индикаторной бумаги. Занесите результаты ваших наблюдений в таблицу.
2. Налейте в две пробирки раствор серной кислоты (или хлороводородной кислоты) и добавьте в одну пробирку 1—2 капли лакмуса (или метилоранжа), а во вторую 2—3 капли фенолфталеина. Обратите внимание на изменение окраски индикатора.
3. В пробирку с раствором гидроксида натрия добавьте 2—3 капли фенолфталеина. Появление малиновой окраски свидетельствует о наличии в растворе гидроксид-ионов.
Повторите опыт по обнаружению гидроксид-ионов в растворе щёлочи при помощи лакмуса или метилоранжа. Результаты опытов оформите в виде таблицы:
Как вы думаете, в какой цвет окрасится капля лакмуса, если ее поместить на срез лимона?
Растворы кислот, щелочей, ряда солей опасны для человека. Растворы многих кислот, попадая на кожу, в глаза, могут вызвать ожоги. Чем сильнее кислота, тем тяжелее ожог. Также опасны и вызывают химические ожоги щёлочи, содержащие гидроксид-ионы. Это свойство отражено в устаревших названиях щелочей, например «едкий натр» (NaOH), «едкое кали» (KOH) (рис. 28). Ионы, входящие в состав солей, также не безопасны для человека. Например, к сильным ядам относятся соли, содержащие катионы свинца, ртути и др.
- Свойства водных растворов сильных электролитов определяются свойствами ионов, образующихся при их диссоциации.
- Кислоты — это электролиты, в водных растворах которых в качестве катионов содержатся только ионы водорода.
- Основания — электролиты, в водных растворах которых в качестве анионов содержатся только гидроксид-ионы.
- Соли — это электролиты, в водных растворах которых содержатся катионы металлов и анионы кислотных остатков.
- Если содержание ионов H+ в растворе больше, чем содержание ионов OH— , такой раствор называют кислым, а раствор, в котором содержание ионов OH— больше, чем ионов H+ , — щелочным.
Познакомившись с диссоциацией солей, кислот и щелочей, мы узнали, что сильные электролиты существуют в растворах только в виде ионов. Следовательно, все реакции, которые происходят между электролитами в растворах, являются реакциями между ионами и называются ионными реакциями.
Ионными реакциями называются реакции, протекающие в водных растворах с участием ионов электролитов.
Многие реакции, протекающие в растворах, относятся к реакциям обмена. Напомним, что к этому типу относятся реакции между сложными веществами, в результате которых эти вещества обмениваются своими составными частями. Такими составными частями веществ в электролитах являются ионы.
Реакции ионного обмена в растворах электролитов протекают только в том случае, если в результате взаимодействия между ионами образуются малодиссоциирующие (вода или другие слабые электролиты), нерастворимые (осадки) и газообразные вещества.
Реакция ионного обмена, сопровождающаяся образованием слабого электролита (воды)Вы уже знаете, что реакция между кислотой и основанием называется реакцией нейтрализации. В результате такого процесса образуются соль и вода:
Уравнение реакции, записанное в такой форме, обычно называют молекулярным (или уравнением в молекулярной форме). Молекулярным уравнением может изображаться любая реакция.
За ходом нейтрализации удобно следить с помощью индикатора, изменение окраски которого свидетельствует об окончании реакции между кислотой и щёлочью.
Три из четырех участников рассматриваемой реакции (HCl, NaOH и NaCl) являются сильными электролитами, т. е. находятся в растворе в виде ионов (рис. 29). Вода — слабый электролит, практически не диссоциирующий на ионы. Поэтому ионное уравнение данной реакции можно записать следующим образом:
Такая запись процесса называется полным ионным уравнением. В ионном уравнении все сильные электролиты записываются в виде формул их ионов. Твердые, плохо растворимые, газообразные вещества и слабые электролиты (включая воду) записываются в виде их молекулярных формул.
Если в правой и левой частях полного ионного уравнения исключить (сократить) одинаковые по химическому составу и числу ионы то получим сокращенное (краткое) ионное уравнение:
В левой части уравнения такого вида обычно сначала записывается катион, а потом — анион. Уравнение показывает, что реакция нейтрализации сводится к взаимодействию ионов водорода с гидроксид-ионами с образованием малодиссоциирующего вещества, каким является вода.
Составьте самостоятельно все три формы уравнений реакции нейтрализации между азотной кислотой и гидроксидом калия. Вы видите, что любая реакция между сильной кислотой и щёлочью сводится к взаимодействию ионов водорода с гидроксид-ионами. Поэтому одно и то же сокращенное ионное уравнение может описывать несколько реакций ионного обмена с участием различных веществ, и ему будут соответствовать несколько уравнений в молекулярном виде.
Реакции ионного обмена, сопровождающиеся образованием осадковВзаимодействие между водными растворами сульфата натрия и хлорида бария — пример процесса образования нерастворимого вещества:
Полное ионное уравнение такой реакции имеет вид:
Если в этом уравнении исключить одинаковые ионы в правой и левой частях (это означает, что такие ионы не участвуют в процессе!), то получим уравнение в сокращенном ионном виде:
Это уравнение показывает, что при взаимодействии раствора сульфата натрия с раствором хлорида бария происходит связывание ионов бария с сульфат-ионами с образованием осадка сульфата бария (рис. 30). Точно такое же сокращенное ионное уравнение будет, если вместо хлорида бария взять, например, нитрат бария , а вместо сульфата натрия — сульфат калия или серную кислоту . Таким образом, одному и тому же сокращенному ионному уравнению будут соответствовать несколько уравнений в молекулярном виде.
При составлении уравнений реакций обмена с образованием осадка необходимо пользоваться таблицей растворимости (см. форзац II), в которой указана растворимость электролитов в воде.
Например, необходимо определить, будет ли выпадать осадок при смешивании растворов нитрата кальция и карбоната калия . Записываем уравнение реакции:
Для определения растворимости карбоната кальция в таблице растворимости находим столбец катиона и строку аниона В месте их пересечения стоит буква «Н». Это означает, что карбонат кальция нерастворим в воде и выпадает в осадок при смешивании растворов нитрата кальция и карбоната калия.
Аналогичным образом определяем, что нитрат калия в воде растворим. Значит, уравнение реакции записываем так:
а в сокращенном ионном виде:
(Прочерк в таблице растворимости означает, что вещество не существует или разлагается водой.)
Реакции ионного обмена, сопровождающиеся выделением газовСвязывание ионов приводит и к образованию газообразного продукта, выделяющегося из раствора.
Например, если к раствору соды прилить раствор серной кислоты, то наблюдается выделение пузырьков углекислого газа (рис. 31):
В полной ионной форме это уравнение записывается следующим образом:
Сокращенное ионное уравнение реакции в этом случае такое:
Таким образом, реакции ионного обмена в растворах электролитов протекают полностью («до конца»), если соблюдается одно из следующих условий:
- образуется осадок;
- выделяется газообразное вещество;
- образуется вода или другой слабый электролит.
С точки зрения теории электролитической диссоциации это означает, что в реакции образуются вещества, полученные в результате связывания ионов в осадок, газ или малодиссоциирующее вещество.
Многие реакции между растворами электролитов являются реакциями между ионами, т. е. ионными реакциями.
Реакции ионного обмена происходят только в том случае, если в результате образуются малорастворимые, газообразные или малодиссоциирующие вещества.
Уравнения реакций, отражающие взаимодействие между ионами в растворе, называются ионными уравнениями — полными или сокращенными.
Расчеты по уравнениям химических реакций, протекающих в растворах электролитовКак вы уже знаете, реакции с участием электролитов осуществляются за счет взаимодействия ионов, содержащихся в их растворах. В таких реакциях могут участвовать также слабодиссоциирующие и малорастворимые вещества и неэлектролиты, например оксиды. При написании ионных уравнений реакций формулы таких веществ записываются в молекулярном виде. Последовательность действий рассмотрим на конкретных примерах.
Пример №1
Взаимодействие гидроксида меди(II) с соляной кислотой.
а) Записываем молекулярное уравнение реакции:
б) Составляем полное ионное уравнение. Для этого определяем, какие вещества являются сильными электролитами и записываем их формулы в ионном виде. Малорастворимые и слабодиссоциирующие вещества записываем в молекулярном виде:
Обратите внимание, что коэффициенты, стоящие перед формулами веществ в молекулярном уравнении, учитываются и в полном ионном уравнении.
в) Записываем сокращенное ионное уравнение. Для этого из левой и правой частей полного ионного уравнения удаляем (вычеркиваем) ионы, не участвующие в химической реакции
Анализируем сокращенное ионное уравнение и делаем вывод, что данная реакция протекает за счет взаимодействия ионов водорода с осадком гидроксида меди(II) с образованием ионов меди(II) и воды.
На основе уравнений реакций, протекающих в растворах электролитов, можно проводить различные количественные расчеты.
Пример №2
Хватит ли ионов водорода, содержащихся в растворе хлороводородной кислоты массой 152 г с массовой долей НCl, равной 12 %, для полного растворения осадка гидроксида меди(II) массой 19,6 г?
Решение
1. Определим химическое количество гидроксида меди (II):
2. Рассчитаем массу хлороводородной кислоты в растворе:
3. Найдем химическое количество HCl и, соответственно, химическое количество ионов водорода в растворе:
Поскольку из 1 моль НCl в результате диссоциации образуется 1 моль ионов водорода, следовательно, из 0,5 моль НCl образуется 0,5 моль ионов водорода, т. е.
4. По сокращенному ионному уравнению составим пропорцию и определим, какое химическое количество ионов понадобится для реакции с химическим количеством 0,2 моль:
Отсюда получим, что х = 0,4 моль ионов водорода — столько потребуется для реакции. Поскольку в растворе имеется 0,5 моль ионов , этого их химического количества будет достаточно для растворения осадка.
Пример №3
Взаимодействие раствора гидроксида натрия с газообразным оксидом серы(IV) SO2.
а) Записываем молекулярное уравнение реакции:
б) Составляем полное ионное уравнение реакции. Для этого определяем, какие вещества являются сильными электролитами и записываем их формулы в ионном виде. Формулу газообразного и воды записываем в молекулярном виде:
в) Записываем сокращенное ионное уравнение:
Из анализа сокращенного ионного уравнения делаем вывод, что данная реакция протекает за счет взаимодействия гидроксид-ионов с молекулами с образованием сульфит-ионов и воды.
Пример №4
Какой объем (дм3 , н. у.) оксида серы (IV) понадобится для реакции с гидроксид-ионами, которые содержатся в растворе гидроксида натрия массой 180 г с массовой долей щёлочи, равной 0,1?
Решение
1. Рассчитаем массу гидроксида натрия в растворе:
2. Определим химическое количество гидроксида натрия в растворе:
Соответственно, химическое количество гидроксид-ионов в растворе также равно 0,45 моль. Поскольку из 1 моль NaOH в результате диссоциации образуется 1 моль гидроксид-ионов, = 0,45 моль.
3. По молекулярному (или сокращенному ионному) уравнению составим пропорцию и вычислим, какое химическое количество понадобится для реакции с NaOH химическим количеством 0,45 моль:
отсюда х = 0,225 моль SO2.
4. Найдем объем оксида серы (IV):
В результате реакций ионного обмена между кислотами и основаниями в растворах образуются соли и вода. При полной нейтрализации кислота и щёлочь расходуются полностью с образованием нейтрального раствора. Если же кислота берется в недостатке по отношению к щёлочи (или наоборот), происходит неполная нейтрализация.
Пример №5
Взаимодействие раствора гидроксида калия с раствором серной кислоты.
а) Составляем молекулярное уравнение реакции:
б) Записываем полное ионное уравнение реакции. Поскольку в данной реакции сильными электролитами являются полное ионное уравнение имеет вид:
в) Записываем сокращенное ионное уравнение:
Пример №6
К раствору массой 200 г с массовой долей серной кислоты, равной 4,9 %, прибавили раствор массой 400 г с массовой долей гидроксида калия, равной 0,056. Какова окраска индикатора лакмуса в растворе после реакции?
Решение
1. Рассчитаем массы веществ в исходных растворах:
2. Определим химические количества веществ:
3. На основании молекулярного уравнения реакции определим химическое количество гидроксида калия, необходимого для полной нейтрализации серной кислоты в растворе:
откуда получим: х = 0,2 моль KOH.
4. Поскольку найденное химическое количество KOH (0,2 моль) меньше содержащегося в исходном растворе (0,4 моль), щёлочь была взята в избытке, и среда полученного раствора щелочная. В таком растворе лакмус окрашивается в синий цвет.
В некоторых случаях при смешивании растворов двух сильных электролитов химические реакции не происходят. Смешаем, например, растворы нитрата натрия и хлорида кальция. Составим молекулярное уравнение предполагаемой реакции обмена:
Определим, какие ионы находятся в полученном растворе, записав полное ионное уравнение:
Очевидно, что в данном случае ионы друг с другом не связываются и никаких изменений в растворе не происходит. Следовательно, реакция просто не идет, а в растворе содержатся ионы четырех видов.
Как проверить электролит в аккумуляторе?
При обучении вождению будущих автомобилистов учат не только тому, как управлять автомобилем, но и из чего он состоит. Чтобы ваш «железный конь» работал как часы, нужно иметь хотя бы минимум знаний по обслуживанию и ремонту автомобиля. Сегодня мы поговорим о том, как проверить электролит в аккумуляторе.
На что влияет уровень электролита?
Автоинструкторы считают, что аккумулятор не требует технического обслуживания, но только в том случае, если он используется при стандартных условиях. Это правильное мнение, но при длительных поездках и при воздействии высоких температур специалисты советуют время от времени контролировать уровень электролита, находящегося в аккумуляторе. Если, конечно, у вас обслуживаемая батарея.
В первую очередь отметим, что электролит состоит из кислоты и дистиллированной воды, то есть вода способна испаряться, например, при высоких температурах.
Если уровень электролита очень низкий, то из-за высыхания внутренних пластинок он теряет свою мощность. А это в последствии приведет к плотному соединению ячеек.
И, наоборот, в случае слишком высокого уровня электролита, излишняя кислота повредит (причем довольно сильно) внешнюю часть аккумулятора. Другие причины неполадок из-за ненадлежащего уровня электролита это:
- саморазрядка, то есть при длительной стоянке машины или из-за высокого потребления тока;
- поломка регулятора напряжения, который стоит в генераторе.
Так что надлежащий уровень электролита — это залог нормального функционирования аккумулятора и машины в целом.
Процедура проверки электролита аккумулятора
Проверить электролит можно двумя способами. Первый — это по максимальной и минимальной отметке, то есть уровень жидкости можно увидеть невооруженным глазом, так как корпус аккумулятора с отметками, как правило, прозрачный. Если уровень находится между отметкой MAX и MIN, то всё в порядке.
Если этих отметок нет, то существует второй способ. Для начала нужно подготовить стеклянную трубочку, где внутренний диаметр не превышает 5 мм.
Далее откручиваем крышку на аккумуляторе и опускаем трубку внутрь, пока она не упрется в предохранительный щиток. Наружное отверстие закрывается пальцем. Затем вытаскиваем трубку. Уровень электролита в ней и есть замеряемый уровень.
Оптимальное значение электролита в аккумуляторе
Считается, что нормальное значение электролита в аккумуляторе должно быть между 10 и 15 миллиметрами. Если полученное значение находится в данном диапазоне, то ваш аккумулятор в порядке и делать с ним ничего не нужно.
Но если значение превышает допустимое, то есть имеется лишняя жидкость, ее можно удалить с помощью груши или шприца. В случае нехватки электролита доливается дистиллированная вода.
Помните, что воду из-под крана заливать нельзя, в противном случае аккумулятор просто разрядится. Температура дистиллированной воды должна быть 15-25 градусов.
Кстати, при работе с электролитом соблюдайте повышенные меры безопасности. Во время осмотра аккумулятора всегда надевайте резиновые перчатки, чтобы кислота не попала на кожу рук из-за чего можно получить ожог. Если же жидкость все же пролилась на незащищенные руки, то как можно быстрее смойте ее проточной водой.
Видеоматериал о том, как проверить уровень и плотность электролита в аккумуляторе:
Удачи за рулем и счастливого пути!
В статье использовано изображение с сайта autotuningnews.ru
Электролиты слабые — Справочник химика 21
Реакции получения слабых электролитов. Слабые электролиты могут быть получепы, например, в результате реакций [c.32]
Оба электролита слабые. Почему знаки энтальпии диссоциации различны [c.76]
Если обозначить общую концентрацию электролита — слабой кислоты НА — через С, моль/л, то концентрация ионов Н+ и А выразится величинами [c.26]
Электропроводность любых электролитов, слабых и сильных, в сравнительно разбавленных растворах возрастает с разбавлением. Это является следствием либо увеличения степени диссоциации, либо увеличения подвижности ионов, либо того и другого. Однако при исследовании растворов хлористого водорода в амиловом спирте в 1890 г. И. А. Каблуков нашел так называемую аномальную электропроводность. Он установил, что при значительном увеличении концентрации (при уменьшении разбавления) электропроводность хлористого водорода в амиловом спирте не уменьшалась, а наоборот, возрастала (рис. 26). Это возрастание электропроводности не могло быть объяснено на основании теории Аррениуса, не может быть объяснено и на основании теории Дебая — Онзагера. [c.104]
Реакции получения слабых электролитов. Слабые электролиты могут быть получены различным способами, приведем некоторые из них. [c.53]
Концентрация электролитов слабого черного щелока недостаточна для высаливания сульфатного мыла. Поэтому в промышленных условиях повышение концентрации электролитов достигается упариванием черных щелоков, которое сопровождается увеличением их плотности. [c.62]
А. Слабые электролиты. Слабые электролиты в растворах диссоциируют неполностью. Например, уксусная кислота диссоциирует по уравнению [c.30]
Перекись водорода является слабым электролитом (слабой кислотой), диссоциирующим на ионы [c.162]
В сочетании с (VII.68) эта формула определяет параметрически зависимость Д6″ от расстояния между пластинами. Впервые такая зависимость при произвольных значениях потенциала Фо была найдена Фервеем и Овербеком [11], которые применили с этой целью один из вариантов метода заряжения. Путем соответствующих преобразований можно показать, что формула (VII.76) и ее аналог, полученный Фервеем и Овербеком, полностью совпадают. Однако ввиду громоздкости найденного выражения Фервей и Овербек ограничились графическим исследованием задачи об устойчивости, тогда как выражение (VII.76) позволяет решить эту задачу аналитически (см. ниже 8). Кроме того, как было показано Муллером [13], формула (VII.76) значительно упрощается в случае высоких и даже средних потенциалов, рассмотрение которых представляет особый интерес. Известно, что пороговая концентрация электролита слабо зависит от валентности побочного иона и, напротив, сильно зависит от валентности противоиона. Этот факт можно легко объяснить, предположив, что потенциал диффузного двойного слоя частиц достаточно высок. [c.87]
Ступенчатая диссоциация кислот и оснований. Кислые и основные соли. Амфотерные электролиты. Слабые [c.124]
Электропроводность любых электролитов, слабых и сильных, в сравнительно разбавленных растворах возрастает с разбавлением. Это является следствием либо увеличения степени диссоциации, либо увеличения подвижности ионов, либо того и другого. Однако при исследовании растворов хлористого водорода в амиловом спирте в 1890 г. И. А. Каблуков нашел так называемую аномальную электропроводность. Он установил, что при значительном увеличении концентрации (при уменьшении разбавления) электропроводность хлористого водорода в амиловом спирте не уменьшалась, а наоборот, возрастала (рис. 29). Это [c.132]
Заменим в рассматриваемой реакции один из сильных электролитов слабым. Например [c.93]
К сильным электролитам условно относят вещества, степень диссоциации которых в растворе превышает 33%, так как, начиная с этого предела, общее число образовавшихся ионов начинает превышать число молекул, не подвергшихся диссоциации. При асредней силы. [c.156]
Титрование сильным электролитом слабого электролита в ai лизе не находит применения. [c.258]
Различают слабые и сильные электролиты. Слабые электролиты (большин- [c.511]
В настоящее время известно, что это совпадение, которое убедило многих ученых в правильности теории Аррениуса, было в значительной мере случайным метод определения степени диссоциации по электропроводности неприменим к растворам солей, и эти растворы во всяком случае не подчиняются уравнению состояния идеальных газов. Тем не менее теория электролитической диссоциации с некоторыми видоизменениями является в настоящее время общепризнанной. Считается, что при растворении вещество, способное образовывать проводящий раствор в данном растворителе, самопроизвольно диссоциирует на ионы. Если растворенное вещество представляет собой соль, сильную кислоту или сильное основание, оно диссоциирует во многих случаях почти нацело при условии, что раствор не является слищком концентрированным ещества, сильно диссоциирующие и дающие с водой хорошо проводящие растворы, называются сильными электролитами Слабые кислоты и основания, например амины, фенолы, большинство органических кислот, некоторые неорганические кислоты и основания, в том числе синильная кислота и гидрат окиси аммония, а также некоторые соли, например хлорная и цианистая ртуть, диссоциированы дри обычных концентрациях лишь в незначительной TeneHH.L9TH вещества представляют собой слабые электролиты = С Соли слабых кислот и сильных оснований или слабых [c.36]
Сольвофобные эффекты не возникают скачком при переходе от одной системы к другой, если такие две системы составлены не из полярно противоположных по свойствам компонентов. Еще раз подчеркнем, что градация здесь носит качественный, а не количественный характер, подобно переходу сильные электролиты—слабые электролиты. [c.75]
Отсюда видно, что расчет совершенно (конечно, в пределах возможных для опыта погрешностей) согласуется с опытом, а потому, наблюдая осмотическое давление (для растворов не солеобразных веществ, т.-е. для не электролитов) слабых растворов, можно определить частичный вес растворенного вещества. Так, если исходить из вышеуказанных чисел, наблюденных Пфеффером для осмотического давления, по формуле рассчитывается в среднем М очень близко к 342, т.-е. к тому числу, которое выводится для частичного веса сахара по его составу и превращениям. [c.239]
Рассмотрим другой, более общин случай, когда оба электролита слабые и присутствуют в сравнимых концентрациях. Ион участвует в равновесиях диссоциации обоих электролитов, и его концентрация входит в выражения для обеих констант равновесия диссоциации [c.204]
Электрохимическая коррозия возникает в растворах электролитов (слабые растворы кислот, щелочей, солей, проводящие ток) при наличии двух различных металлов или одного металла, имеющего посторонние включения в этих случаях образуется гальваническая пара. Если материал корпуса аппарата является анодом, то происходит его постепенное коррозионное разрушение. [c.87]
Опытным путем установлено, что закон действия масс приложим только к разбавленным растворам электролитов, слабо диссоциирующих на ионы. Электролиты, хорошо диссоциирующие на ионы, отступают от закона действия масс, поэтому к сильным электролитам закон действия масс неприменим. Для сильных электролитов необходимо учитывать активность ионов, о чем будет сказано позднее. [c.113]
При написании уравнений в полной ионной форме все сильные растворимые электролиты изображают как полностью ионизированные. Неэлектролиты и электролиты слабые (малодиссоциированные) изображают в молекулярной форме так же изображают мало-и труднорастворимые осадки (AgJ). После сокращения подобных [c.117]
Концентрация электролитов слабого черного щелока, как это уже указывалось, недостаточна для выделения сульфатного мыла. Поэтому в производственных условиях прибегают к отстаиванию щелоков повышенной плотности — укрепленных и полуупаренных, а также съему мыла, выделившегося в баках слабых черных щелоков. Плотность черных щелоков, при которой производится выделение сульфатного мыла в производственных условиях, колеблется в широких пределах. В зависимости от конкретных условий плотность щелоков изменяется от 1120— ИЗО и даже 1100 кг/м до 1180—1200 кг/м . При обычном для древесины сосны составе смолистых веществ плотность черного щелока, соответствующая достижению предельной концентрации электролитов составляет 1150—1160 кг/м . Устойчиво высокие коэффициенты извлечения сульфатного мыла достигаются при плотности черного щелока 1170—1180 кг/м . [c.63]
В результате измерения электрической проводимости большого числа электролитов установлено, что их следует подразделить на две группы сильные и слабые электролиты. Слабые электролиты в растворе диссоциируют неполностью, обратимо, вследствие чего между недиссоциированной частью и ионами устанавливается равновесие, например [c.77]
Большое внимание уделяется рассмотрению влияния pH на сорбцию слабых электролитов слабыми ионитами [15]. Введен весьма вероятный для большого числа ионитов и противоионов постулат обмен ионов происходит только на ионизированных функциональных группах ионита, т. е. водородная форма резинатов для катионитов и основная форма для анионитов не принимают участия в сорбции ионов, ионном обмене. Ввиду того что нри обмене ионов участвуют по меньшей мере два типа противоионов, а рассматриваемая задача состоит в выявлении зависимости сорбированного количества одного из противоионов при изменении кислотности раствора, необходимо ввести в качестве ограничения постоянство концентрации второго типа ионов в растворе — Сз. В этом случае для слабого электролита 1 (см. уравнения (3. 49) и (3. 50)) и для слабого ионита уравнение (3. 45) принимает вид [c.99]
В другом крайнем случае, для слабозаряженных коллоидных частиц, величина у, как было показано в 2 гл. VU, приближенно равна . При этом критическое значение концентрации электролита слабее зависит от величины заряда противоионов, а [c.298]
I. Постановка задачи. В работе рассматривают круг задач, иоторые относятся к разделу курса Физическая химия с названием Растворы электролитов Выделено три типа задач- сильные электролиты, слабые электролиты, гидролиз солей [c.495]
Иногда возникает необходимость рассчитать степень диссоциации слабого электролита в присутствии избытка сильного электролита, имеющего с первым общий ион. Рассмотрим для простоты случай симметричных г—г-валентных электролитов слабого КА (индекс 1) и сильного МА (индекс 2). По условиям задачи и, следовательно, A = 2-fа1С1 С2. Поскольку [c.203]
Канадские ученые [272] изучили кислотно-основное взаимодействие большого числа кислот различной силы в среде этилендиамина. В качестве основного титранта они использовали стандартные этилендиаминовые pa TSQpbi монолитиевой соли этилендиамина LiHN h3 h3Nh3. Установлено, что даже сильные в воде электролиты слабо диссоциируют в этилендиамине. Это указывает на то, что в этом растворителе сила кислот изменяется не в соответствии с изменением их степени диссоциации, как в водных растворах, а определяется степенью ионизации продукта присоединения кислоты к этилендиамину. Это подтверждается другими авторами [273, 274], отмечающими, что в отличие от водных растворов разница между степенью диссоциации сильных и слабых электролитов в среде этилендиамина невелика и не является мерой силы кислот и оснований в нем. [c.86]
Существует способ, позволяющий однозначно и совершенно точно вычислить величину /I и pH растворов гидролизующихся солей независимо от их типа. Для этого исходят из общего правила, что все растворы электролитов (слабых и сильных) электронейтральны, иначе говоря, сумма концентраций всех положительно заряженных частиц равна сумме концентраций отрицательно заряженных частиц в растворе. В качестве примера рассмотрим гидролиз соли ВзАп, образованной трехосновной слабой кислотой и слабым однокислотным основанием, например, (КН4)зР04, предполагается отсутствие полимеризации ионов и молекул. [c.249]
Скорость медленной коагуляции заметно изменяется от механического перемешивания особенно в начальный момент. В этом случае пропадает иногда наблюдавхмый 8-образный характер кривой коагулящш. Процесс вначале идет гораздо быстрее. При перемешивании имеет значение ортокинетическая коагуляция в случае полидисперсных систем. В некоторых случаях, когда коагулирующая способность электролита слаба или электролита прибавлено очень мало, механическое пере-меш ивание задерживает коагуляцию (Фрейндлих). [c.250]
Общая химия (1984) — [ c.257 ]
Аналитическая химия. Т.1 (2001) — [ c.55 ]
Физическая и коллоидная химия (1988) — [ c.190 , c.191 , c.221 , c.223 ]
Физическая химия (1987) — [ c.196 ]
Курс аналитической химии. Кн.1 (1968) — [ c.2 , c.9 , c.159 ]
Учебник общей химии (1981) — [ c.139 , c.141 ]
Общая химия в формулах, определениях, схемах (1996) — [ c.122 ]
Руководство по физической химии (1988) — [ c.203 , c.205 ]
Физическая химия (1978) — [ c.346 ]
Общая химия в формулах, определениях, схемах (0) — [ c.122 ]
Химия (2001) — [ c.181 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.122 ]
Общая химия в формулах, определениях, схемах (0) — [ c.122 ]
Курс аналитической химии (2004) — [ c.27 ]
Справочник Химия изд.2 (2000) — [ c.172 , c.257 ]
Химия справочное руководство (1975) — [ c.481 , c.483 ]
Электрохимия растворов (1959) — [ c.35 , c.37 , c.38 , c.40 , c.58 , c.216 , c.223 , c.249 , c.250 ]
Электрохимия растворов издание второе (1966) — [ c.24 ]
Учебник физической химии (1952) — [ c.271 ]
Физическая химия Термодинамика (2004) — [ c.129 ]
Введение в электрохимию (1951) — [ c.24 ]
Неорганическая химия (1974) — [ c.169 ]
Неорганическая химия Издание 2 (1976) — [ c.211 , c.212 ]
Аналитическая химия (1963) — [ c.23 ]
Аналитическая химия (1965) — [ c.31 , c.33 , c.37 , c.56 ]
Качественный анализ (1951) — [ c.52 ]
Качественный анализ 1960 (1960) — [ c.52 ]
Курс качественного химического полумикроанализа 1962 (1962) — [ c.79 ]
Курс качественного химического полумикроанализа 1973 (1973) — [ c.76 ]
Общая химия 1982 (1982) — [ c.237 , c.239 ]
Общая химия 1986 (1986) — [ c.228 , c.232 ]
Основы аналитической химии Книга 1 (1961) — [ c.46 , c.51 ]
Аналитическая химия (1975) — [ c.45 , c.46 ]
Учебник общей химии 1963 (0) — [ c.131 ]
Общая и неорганическая химия (1959) — [ c.146 ]
Неорганическая химия (1978) — [ c.149 ]
Общая химия Издание 4 (1965) — [ c.123 ]
Курс аналитической химии Издание 3 (1969) — [ c.92 , c.159 ]
Физическая и коллоидная химия (1957) — [ c.145 , c.148 ]
Общая химия Издание 18 (1976) — [ c.234 ]
Общая химия Издание 22 (1982) — [ c.237 , c.239 ]
Курс аналитической химии Издание 5 (1981) — [ c.76 , c.115 , c.133 ]
Курс аналитической химии (1964) — [ c.46 ]
Курс физической химии Том 2 Издание 2 (1973) — [ c.372 ]
Физическая и коллоидная химия (1964) — [ c.237 ]
Физическая и коллоидная химия Учебное пособие для вузов (1976) — [ c.141 ]
Физическая химия и химия кремния Издание 3 (1962) — [ c.180 , c.183 ]
Физическая и коллоидная химия (1954) — [ c.79 ]
Физическая и коллоидная химия (1964) — [ c.41 , c.43 ]
Физическая химия для биологов (1976) — [ c.204 , c.205 ]
Учебник физической химии (0) — [ c.290 ]
Курс аналитической химии Издание 2 (1968) — [ c.48 ]
Курс аналитической химии Издание 4 (1977) — [ c.17 ]
Общая химия Изд2 (2000) — [ c.212 , c.218 ]
Курс качественного химического полумикроанализа (1950) — [ c.55 , c.61 ]
Физическая и коллоидная химия (1960) — [ c.133 ]
Качественный химический полумикроанализ (1949) — [ c.56 ]
Основы аналитической химии Издание 2 (1965) — [ c.30 ]
Основы общей химии Т 1 (1965) — [ c.178 ]
Общая химия (1968) — [ c.201 , c.211 ]
Общая химия Биофизическая химия изд 4 (2003) — [ c.83 ]
Курс общей химии (0) — [ c.158 ]
Курс общей химии (0) — [ c.158 ]
Основы общей химии том №1 (1965) — [ c.178 ]
Предмет химии (0) — [ c.158 ]
Химия Справочник (2000) — [ c.131 ]
Как проверить АКБ автомобиля, как проверить автомобильный аккумулятор на работоспособность
Проверка аккумулятора автомобиля – необходимость, с которой часто сталкиваются автовладельцы. Это можно сделать в автосервисах, доверив диагностику специалистам, и самостоятельно специальными приборами или подручными средствами.
Этапы диагностики
Алгоритм как проверить аккумулятор автомобиля на работоспособность :
- визуальная диагностика;
- контроль уровня электролита;
- контроль напряжения;
- исследование с помощью нагрузочной вилки;
- определение плотности электролита в банках;
- проверка объема АКБ.
Визуальный осмотр
Специалисты рекомендуют проводить внешний осмотр аккумулятора при каждом открытии капота. Корпус должен быть целым, а крепление клемм надежным.
В процессе эксплуатации на поверхности прибора скапливаются грязь, влага, подтеки от кипящего электролита. Клеммы должны быть чистыми — их окисление в совокупности с внешними загрязнениями приводит к росту риска глубокого разряда, который сокращает срок службы прибора.
Как проверить аккумулятор на наличие саморазряда: подключите вольтметр к клемме, другим проведите по поверхности аккумулятора. Если был разряд, проведите чистку — уберите остатки электролита раствором пищевой соды. Зачистите клеммы наждачной бумаги.
Проверка уровня электролита
Для диагностики аккумулятора используется стеклянная уровневая трубка с делениями. Нормальный уровень электролита – 10-12 мм выше пластин.
Состояние аккумулятора проверяется так:
- трубку вводят в заливное отверстие;
- аккуратно продвигают до соприкосновения с сеткой сепаратора;
- затыкают отверстие пальцем;
- вытаскивают трубку.
Уровень жидкости в трубке соответствует уровню электролита в аккумуляторе.
Из-за снижения уровня электролита открываются свинцовые пластины и окисляются, что сокращает срок службы прибора. Восстанавливают уровень дистиллированной водой.
Также обращайте внимание на прозрачность жидкости. Если цвет электролита темный, значит он с примесями окислов. Это снижает способность держать зарядку.
Измерение напряжения
Измерение напряжения – важный этап в диагностике АКБ . Проверять его нужно мультиметром. Это недорогой прибор, который в электронной версии стоит приобрести каждому автовладельцу.
Как проверить заряд аккумулятора автомобиля мультиметром:
- перевести прибор в режим измерения постоянного напряжения;
- установить диапазон выше стандартных максимальных значений;
- черный щуп мультиметра подключить на минус АКБ;
- красный щуп подключить на плюс;
- зафиксировать показания.
Стандартный уровень напряжения аккумулятора – 12,6 вольт. Если оно ниже, требуется зарядка аккумулятора.
С помощью мультиметра также моно проверить АКБ на замыкание. Для этого подсоедините щупы к выходам полностью заряженной батареи. Если показания меньше 10,7 вольт, одна из банок вышла из строя.
Проверка нагрузочной вилкой
Проверка с помощью нагрузочной вилки (прибора, создающего нагрузку аналогичную, возникающую при работающем двигателе) позволяет выявить работоспособность аккумулятора и оценить его состояние.
Этапы диагностики:
- подключите клеммы контрольного прибора к выходам АКБ;
- если показания ниже 12,6 -1 2,9 вольт, зарядите аккумулятор;
- подайте нагрузку на 5 секунд;
- зафиксируйте показания.
Нормальное напряжение – свыше 10,2 вольт. Показания около 9 вольт говорят, что батарея изношена. Если напряжение ниже 9 вольт, требуется замена аккумулятора.
Проверка плотности электролита
Проверка плотности проводится ареометром. Для этого трубку помещают в заливное отверстие и откачивают часть жидкости. Электролит нужно проверять в каждой банке. Рекомендуем проводить проверку при температуре 20-30 °C., тогда стандартными показателями будут 1.27 – 1.29. При повышенной плотности долейте дистиллированную воду. Если плотность снижена, добавьте раствор электролита (можно добавить жидкость из банки с нормальной либо повышенной плотностью).
Низкая плотность электролита зимнее время можем привести к замерзанию жидкости и, как следствие, деформации корпуса или трещинам.
Повышенная плотность станет причиной преждевременной коррозии элементов аккумулятора, и выведет батарею из строя.
Проверка емкости АКБ
Емкость автомобильного аккумулятора всегда указывается в сопроводительных документах. В процессе эксплуатации показатель уменьшается, что приводит к потере мощностью и снижению эксплуатационных характеристик.
Проверить реальную емкость автомобильного аккумулятора можно контрольным разрядом: АКБ полностью заряжают, разряжают, замеряют время до окончания заряда и по формуле высчитывают емкость:
Е [А*час]=I[А]*T[час] .
Если реальная емкость отличается от номинальной на 70% и больше, АКБ нужно срочно заменить.
Общие советы:
- Поверхность батареи должна быть чистой, своевременно удаляйте следы масла, подтеки электролита, механические загрязнения
- Регулярно заряжайте батарею
- Проверяйте уровень электролита, особенно в летнее время
- Контролируйте и корректируйте плотность электролита в банках аккумулятора
Эти простые меры позволят вам продлить срок эксплуатации прибора и избежать возникновения нештатных ситуаций.
Хотите обновить машины? Посмотрите онлайн каталог новых и б/у авто в салоне «FAVORIT MOTRS». Мы показываем полную информацию о машине с пробегом до осмотра и тест-драйва в личном кабинете. Забронируйте бесплатно до 3 машин и приезжайте на осмотр в наши автосалоны в Москве. Бронь доступна для всех жителей России.
Оцените наш сервис и подберите себе хорошую машину по доступной цене!
Слабый электролит: определение и примеры — видео и стенограмма урока
История слабого электролита
Слабый электролит принадлежит к большему семейству электролитов, показанных на этой диаграмме.
Электролит — это вещество, которое может распадаться на ионы (в растворе) и обладает способностью проводить электричество (в растворе). Удивительно, что такие молекулы, как хлорид натрия (NaCl), уксусная кислота (Ch4COOH) и азотная кислота (HNO3), могут проводить электричество.
Имейте в виду, что электролиты — это заряженные частицы, которые могут ионизироваться. Ионизировать — это причудливый способ сказать «распадаться на части или растворяться в ионах в растворе». Ионы — это атомы, которые несут заряд из-за лишних или отсутствующих электронов в их энергетической оболочке. Они могут существовать в виде катиона или аниона в зависимости от заряда. Катион , — это ион, который заряжен положительно, а анион , — отрицательно. Об этом важно помнить, когда мы рассмотрим пример слабой диссоциации электролита в воде.
Проводимость слабых электролитов
Что касается проводимости, когда электричество проходит через раствор, скажем, через воду, ионы слабого электролита переносят этот заряд, способствуя возникновению электрического тока (в воде). Важно понимать взаимосвязь между силой проводимости и концентрацией ионов слабого электролита в растворе. Частичная диссоциация слабого электролита напрямую влияет на концентрацию (то есть присутствие) их ионов в растворе.Из-за частичной диссоциации в растворе остается меньше ионов. В результате эта пониженная концентрация ионов ослабляет электропроводность. Далее мы рассмотрим хлорид ртути (II) со слабым электролитом и его способность проводить электричество в растворе.
Пример слабого электролита
Как показано, хлорид ртути (II) (молекулярная формула: HgCl2) сбрасывается в раствор на водной основе. Когда HgCl2 вступает в реакцию с водой, она начинает растворяться и частично диссоциировать, образуя ионы в растворе.Некоторые молекулы HgCl2 диссоциируют, а другие — нет. Ионы хлорида и ртути, присутствующие в растворе, мигрируют к своим электродам на основе старинного принципа притяжения противоположностей. Таким образом, катионы (Hg +) перемещаются к отрицательному электроду, а анионы (Cl-) перемещаются к положительному электроду. . Эта миграция выполняется для облегчения проведения электрического тока в растворе. Но имейте в виду, что хотя HgCl2 является проводником электричества, эта проводимость плохая из-за его частичной диссоциации в растворе.
Краткое содержание урока
Слабые электролиты относятся к большему семейству веществ, называемых электролитами. Электролиты — это вещества, которые ионизируются в растворе и являются проводниками электричества, тогда как слабые электролиты — это электролиты, которые не полностью диссоциируют на ионы в растворе и только частично ионизируются в растворе (примерно 1-10%). Ионизация в растворе относится к соединениям, которые растворяются в растворе с образованием ионов. Ионы — это атомы, которые заряжаются из-за увеличения или уменьшения количества электронов. Катионы и анионы — это два типа ионов, которые имеют положительный и отрицательный заряд, соответственно. Слабые электролиты в растворе частично диссоциируют на ионы и являются слабыми проводниками электричества. Типы слабых электролитов включают слабые кислоты и основания. Примеры слабых электролитов включают уксусную кислоту и хлорид ртути (II).
Практика:
Слабый электролит: тест с определениями и примерами
Инструкции: Выберите ответ и нажмите «Далее».В конце вы получите свой счет и ответы.
Вы строите электрохимическое устройство и хотите использовать слабую кислоту HgCl2. На что распадется этот слабый электролит при растворении в растворе?
Создайте учетную запись, чтобы пройти этот тест
Как участник, вы также получите неограниченный доступ к более чем 84 000 уроков математики, Английский язык, наука, история и многое другое.Кроме того, получайте практические тесты, викторины и индивидуальные тренировки, которые помогут вам добиться успеха.
Попробуй это сейчасНастройка займет всего несколько минут, и вы можете отменить ее в любой момент.
Уже зарегистрированы? Авторизуйтесь здесь для доступа
В чем разница между сильным и слабым электролитом?
posted on
В чем разница между сильным и слабым электролитом?
Разница в том, что сильный электролит полностью диссоциирует в воде, тогда как слабый электролит диссоциирует частично.Например, соляная кислота (HCl) и фтористоводородная кислота (HF) диссоциируют в воде с образованием H + ( эти реактивные ионы H + разделяют неподеленную пару электронов на атоме кислорода воды (H 2 O ) с образованием иона гидроксония, H 3 O + . Следовательно, мы будем более правы, если скажем, что HCl и HF диссоциируют в воде с образованием H 3 O + )
Если вы протестируете проводимость при одинаковых концентрациях HCl и HF, вы заметите, что лампочка тестера проводимости светится ярче в растворе HCl, чем в растворе HF.Эта разница в яркости объясняется тем, насколько хорошо каждое химическое вещество диссоциирует в воде.
Например, HCl обычно диссоциирует на 100% в воде. Следовательно, HCl — сильный электролит.
Вот модель, показывающая, как HCl диссоциирует в воде
Диссоциация HCl в водеС другой стороны, только небольшая часть молекул HF диссоциирует в воде.
Вот модель, показывающая, как HF диссоциирует в воде
Диссоциация HFКак вы можете видеть, у нас есть более длинная стрелка, указывающая на реагенты, и более короткая стрелка, указывающая на продукты.Более длинная стрелка означает, что предпочтительна обратная реакция и что продукты легко объединяются, чтобы вернуть реагенты. С другой стороны, более короткая стрелка означает, что прямая реакция не является предпочтительной и что только небольшая часть HF диссоциирует в воде.
Следовательно, HF — слабый электролит.
Сильные и слабые электролиты также можно наносить на основания и другие соединения, которые растворяются в воде с образованием ионов. Примеры оснований, которые являются сильными электролитами, включают гидроксид натрия и многие другие.Примеры слабых оснований включают аммиак и многие другие.
Чтобы узнать больше о решениях, которые могут проводить электрический ток, щелкните здесь.
Демонстрация электропроводности электролитов | Chemdemos
Эту демонстрацию можно использовать для иллюстрации того, как количество ионных частиц в растворе классифицирует водный раствор как сильный электролит, слабый электролит или неэлектролит. Эту демонстрацию можно использовать для обсуждения таких тем, как процесс растворения, межмолекулярные силы или относительная сила химических связей по сравнению сМВФ. Эффективность этой демонстрации повышается, когда 1) учащиеся делают свои собственные прогнозы, наблюдения и заключения; 2) построить диаграммы уровня частиц всех протестированных растворов и твердых веществ; и 3) отвечать на вопросы и писать пояснения к решениям.
Существует черновик учебного задания, похожего на POGIL, который может сопровождать (и улучшать) эту демонстрацию.
Задачи обучения
1. Объясните, почему вода является полярной молекулой и как пять или шесть молекул воды взаимодействуют с веществами, участвуя в процессе растворения.
2. Из физики примените концепции «притяжения разнородных зарядов», дипольного момента и векторов, чтобы помочь объяснить, почему полярные вещества и растворимые ионные вещества растворяются в воде.
3. Отнесите водный раствор к категории с сильным электролитом, слабым электролитом или неэлектролитом.
4. Представьте твердые ионные вещества, полярные ковалентные вещества и ковалентные вещества с помощью диаграмм уровней частиц.
5. Изобразите процесс растворения твердых ионных веществ и полярных ковалентных веществ, а также ковалентных веществ, используя диаграммы уровней частиц и химические уравнения
6.Ясно проиллюстрируйте и объясните различия между растворами сильного электролита, слабого электролита и неэлектролитных растворов.
7. Определите слабые кислоты, сильные кислоты, слабые основания и сильные основания.
Компьютерная анимация миграции катиона Na + к отрицательному электроду прибора для проверки проводимости.
Компьютерная анимация миграции аниона Cl — к положительному электроду прибора для проверки проводимости.
Расчетное время для проведения демонстрации
Отведите около 15 минут на выполнение основных аспектов этой демонстрации. Выделите один урок (50 минут) для демонстрации, демонстрации компьютерной анимации, предоставьте студентам время для наблюдения и записи своих наблюдений, рисования диаграмм частиц и ответов на вопросы с интерактивными кнопками.
Как реакции на границе анод / электролит определяют характеристики катода в литий-ионных батареях?
Сегодня общеизвестно, что материаловедение в области электрохимического накопления энергии должно следовать системному подходу, так как взаимодействие между активными материалами, электролитом, сепаратором и различными неактивными материалами (связующее, токоприемник, проводящие наполнители, корпус ячейки) , так далее.), которые имеют такое же или даже большее значение, чем свойства и рабочие параметры только отдельных материалов. В частности, для литий-ионных батарей широко признано, что электролит взаимодействует и реагирует с электродами. Здесь мы сообщаем, как реакции на графитовом аноде (включая разложение электролита и образование межфазной фазы твердого электролита (SEI)) влияют на работу катода LiCoO 2 (LCO) и литий-ионного элемента во время цикла.Мы обсуждаем влияние SEI-образующей добавки к электролиту виниленкарбоната (VC) и влияние графитовых анодов с различной площадью поверхности на циклическую стабильность, потенциал окончания заряда (EOC) и окончания разряда (EOD) катода LCO. Таким образом, мы выясним механизм отказа LCO / графитовых ячеек, показав, что образование и рост SEI на аноде, увеличение сопротивления катода, электрода и деградация электролита в целом, а также снижение емкости и мощности ионно-литиевого элемента. фактически являются сильно взаимосвязанными процессами.
Литий-ионные батареи коммерчески доступны уже более 20 лет, 1 началось в области портативной электроники 2,3 и теперь применяется в автомобильных и сетевых батареях. 4 Первая промышленная ячейка состояла из катода LiCoO 2 (LCO) и углеродистого анода. Сегодня элементы LCO / графит с электролитами на основе органических карбонатных растворителей представляют собой систему элементов, которая по-прежнему успешно работает на рынке портативной электроники.Хорошо известно, что деградация и старение LCO / графитовых ячеек начинается с образования межфазной границы твердого электролита (SEI) и роста на аноде, 5,6 , но окончание срока службы (EOL) определяется постепенным развитием большой сопротивление на катоде 7–9 , которое увеличивается и приводит к исчезновению мощности во время цикла. Эти процессы сопровождаются сильным снижением емкости элемента из-за циклирования, при этом 80% номинальной емкости элемента обычно, но несколько произвольно, определяется как критерий EOL.Последнее означает, что ячейка считается «мертвой», хотя все еще доступно 80% емкости. Критерий EOL 80% также был принят для химического состава ячеек, отличного от LCO / графита.
В этой публикации мы хотим разъяснить механизм отказа LCO / графитовых ячеек, показывая, что образование и рост SEI на аноде, увеличение сопротивления на катоде, деградация электрода и электролита в целом, а также снижение емкости и мощности клетка — это фактически сильно взаимосвязанные процессы.
Как правило, LCO / графитовые элементы заряжаются до максимального напряжения элемента 4,2 В. 10,11 Это соответствует извлеченному количеству Li около ок. 50%, что дает Li 0,5 CoO 2 в «полностью» заряженном состоянии. Заряд выше этого напряжения возможен, но приводит (среди других реакций) к серьезным структурным изменениям LCO, окислению электролита на катодной стороне, осаждению металлического лития и усиленному восстановлению электролита на стороне графитового анода (Рисунок 1).
Увеличить Уменьшить Сбросить размер изображения
Рисунок 1. Перегрузка литий-ионного элемента на основе LCO / графита. Дендритное осаждение Li на графите происходит параллельно с разложением электролита и ухудшением качества катодного материала. Последнее обсуждается в тексте.
Несколько фазовых переходов происходят во время перезарядки LCO. Структура претерпевает необратимый переход беспорядок / порядок из гексагональной в моноклинную фазу. 12 Сообщалось, что потенциал этого перехода составляет примерно> 4,2 В по сравнению сЛи / Ли + . 12–15 Kamarulzaman et al. предположили, что электрохимическое старение LCO происходит за счет локальных структурных изменений от синтезированного при высокой температуре LiCoO 2 (HT-LCO) со слоистой структурой до синтезированного при низкой температуре LiCoO 2 (LT-LCO) со структурой с отклонением шпинели. 16–19 Авторы предполагают, что это изменение структуры подтверждается структурной близостью шпинели к моноклинной фазе, происходящей в конце заряда (EOC).Кроме того, мы заключаем, что отношение лития к переходному металлу (TM) и кислороду в Li 0,5 CoO 2 равно таковому в LiCo 2 O 4 , что может способствовать образованию более стабильной шпинели. фаза для этого отношения Li / TM / O. Шпинель показывает гораздо более низкую устойчивость к циклическим нагрузкам. 18,20–22
Известно, что помимо структурных изменений в электродах LCO происходит растворение Со. Amatucci et al. Установлено, что потеря Co на катоде LCO происходит при потенциалах 4.2 В и выше. 23 Они упомянули прямую взаимосвязь между падением параметра решетки c и растворением Со. Кроме того, циклические характеристики электродов LCO снижаются с увеличением потерь Со на катоде. В общем, известно, что растворение LCO кобальтом происходит на поверхности частиц даже без приложения напряжения. 24 Растворенный Co внедряется в SEI анода, а также в поверхностный слой, сформированный на катоде, 24,25 , следовательно, и графит, и LCO находятся под влиянием присутствия ионов Co в электролите. 26 Еще один момент, о котором следует упомянуть, — это микротрещины частиц LCO при циклическом воздействии, 18,27 , которые, как полагают, влияют на характеристики циклирования. Однако роль этих дефектов до сих пор не выяснена.
Полные ячейки LCO / графит интенсивно исследовались Dahn et al. Изучая кулоновскую эффективность (CE) и скорость проскальзывания емкости нескольких ячеек с разными C-коэффициентами, они подтвердили отраслевые знания о том, что календарный, а не циклический срок жизни является доминирующим для старения клеток. 28 Кроме того, они исследовали использование высокоточного анализа дифференциальной емкости для расчета электродных потенциалов без использования электрода сравнения. 29 Они показали хорошее согласие между расчетными и практическими данными для кратковременных циклов в LiMn 2 O 4 / графитовых полных ячейках. Дальнейшие исследования влияния добавок в этих элементах были выполнены, 30 , которые выявили замечательные свойства добавки к электролиту виниленкарбоната (ВК) и различных комбинаций добавок. 31,32
Ухудшение LCO во время перезарядки (и связанные с этим проблемы безопасности) указывает на важность точного контроля и мониторинга потенциала EOC для LCO. Для мониторинга потенциалов потребуется установка с 3 электродами и электродом сравнения. При большинстве электрохимических исследований материалов в научных исследованиях используется трехэлектродная установка. Однако на практике в коммерческих литий-ионных элементах используется установка с двумя электродами. Напряжение ячейки, а не электродные потенциалы отслеживаются и контролируются.Во время работы ячейки отдельная информация об отдельных электродах не собирается.
Графитовый углерод является наиболее широко используемым анодным материалом в литий-ионных батареях и активно изучается. 33–36 Зарядка графита происходит за счет внедрения Li, что приводит к образованию так называемых «стадий» со стехиометрией LiC 12 для стадии 2 и LiC 6 для стадии 1. 36 Для безопасного и успешного При эксплуатации графитовые аноды нуждаются в защитной межфазной границе твердого электролита.Генерация SEI во время формирования клеток происходит в основном в первом цикле, но продолжается в следующих циклах с более низкой скоростью. 7
В грубом приближении образование SEI можно рассматривать как результат реакций разложения электролита в процессе зарядки анода. 37 Были идентифицированы различные классы продуктов разложения электролита (см. Таблицу I). 37,38 В частности, те продукты, которые содержат литий с катода, должны быть сведены к минимуму, поскольку связанный процесс потребления лития необратимо иммобилизует часть активного лития, обеспечивая реакцию заряда / разряда элемента, т.е. .е., этот процесс приводит к потере мощности во время цикла.
Таблица I. Примеры веществ, образующихся в результате разложения электролита: их происхождение и их влияние на рабочие характеристики. 41
| Продукты разложения | Происхождение | Влияние на производительность |
|---|---|---|
| CH 2 = CH 2 , H 2 95, растворитель | )Повышение давления в ячейке, потеря (высыхание) электролита | |
| Полимеры e.грамм. PEO | Растворитель (и) | Вклад SEI, сопротивление элемента, потеря электролита (высыхание) |
| LiF | LiPF 6 | Изменение проводимости электролита, вклад SEI, сопротивление элемента |
| Li 2 CO 3 , (CH 2 OCO 2 Li) 2 , CH 3 OLi | Растворитель (ы) Li (с катодом) | Вклад SEI, сопротивление ячейки, емкость Li потеря → Изменение материального баланса в ячейке |
Как следствие, предпочтение отдается компонентам электролита, которые инициируют или принимают участие в процессе образования SEI и не потребляют необратимо литий.Предполагая, что основная часть реакции образования SEI основана на восстановительной полимеризации дополнительных мономеров, соединения на основе винилена 39–41 38,42 или изоцианата 43,44 должны быть высшими добавками к электролиту, образующим SEI, как меньше ( подвижный) Li участвует в процессе полимеризации соответствующих мономеров винилена и изоцианата. Действительно, виниленкарбонат 25,45–50 считается прототипом добавки к электролиту и нашел широкое применение в исследованиях и промышленности.
Необходимо учитывать, что необратимая иммобилизация (= расход) Li + изменит соотношение баланса массы катода LCO и графитового анода в ячейке. Напряжение ячейки EOC, равное 4,2 В, означает, что потенциал EOC графитового электрода равен нескольким 10 мВ по отношению к Li / Li + , а потенциал EOC катода составляет 4,2 В положительно по отношению к этому потенциалу (рисунок 2 справа). Если емкость элемента ограничена анодом, то есть емкость катода имеется в избытке, то избыток Li с катода приведет к осаждению Li на аноде во время зарядки.Соответственно, анод достигнет потенциала ≤0 В относительно Li / Li + . Если во время зарядки окно напряжения на ячейке составляет 4,2 В, катодный потенциал также смещается вниз (рис. 2, в центре). Чтобы избежать проблем безопасности, связанных с покрытием литием, обычно литий-ионные элементы ограничиваются не анодом, а катодом после сборки, при этом соответствующий избыток анода находится в диапазоне прибл. 10–18% емкости. В этом случае общий анодный потенциал будет оставаться значительно выше 0 В по сравнению с Li / Li + и окном напряжения ячейки 4.2 В переместится к положительным потенциалам, то есть к потенциалам, при которых катод LCO может испытывать перезаряд (рисунок 2, слева).
Увеличить Уменьшить Сбросить размер изображения
Рисунок 2. Сдвиг окна напряжения в зависимости от балансировки электродов. 59
Чтобы отслеживать потенциалы отдельных электродов и то, как они меняются во время цикла в практических условиях, мы показываем результаты литий-ионных элементов, где циклический заряд / разряд выполнялся в режиме контроля напряжения элемента в двухэлектродный режим, но в котором потенциалы отдельных электродов отслеживаются с помощью электрода сравнения в трехэлектродном режиме.С помощью этой простой, но эффективной методологии мы продемонстрируем, как графиты с различной удельной поверхностью и использование VC, формирующего анод SEI, повлияют на характеристики LCO-катода.
Использовались 3-электродные полные ячейки Swagelok Т-типа с катодом LCO (Toda Advanced Materials Inc.) и различными графитовыми анодами (T44 и KS6 Timcal, Швейцария). Металлический литий вводился в систему в качестве электрода сравнения. 1 M LiPF 6 в этиленкарбонате: диметилкарбонате; (EC: DMC) 1: 1 (по массе) и полиолефин (Viledon, Freudenberg 2190) использовали в качестве электролита и сепаратора.
Электроды KS6 и T44 были отлиты на медной фольге из суспензии, содержащей 90 мас.% Активного материала, 5 мас.% Технического углерода SuperC65 (Timcal, Швейцария) в качестве проводящего агента и 5 мас.% Связующего PVDF (Kynar, Kynarflex 761) в NMP. растворитель. Электроды сушили при 120 ° C под вакуумом в течение 24 часов.
ЭлектродыLCO были приготовлены литьем суспензий с составом 87 мас.% Активного материала, 5 мас.% Связующего ПВДФ и 8 мас.% Проводящих углеродных агентов (SuperC65, SFG-6L Timcal, Швейцария) (1: 1) в массовом соотношении, на алюминиевую фольгу.После сушки при 120 ° C в течение 24 часов электроды LCO прессовали при 1,5 т / см 2 .
Анод и катод были собраны в Т-образной ячейке Swagelok, где емкость LCO-электрода составляла 0,6 мАч. Удельные токи для 1C были определены как 140 мА изб. -1 для LCO и 372 мА изб. -1 для графита. Баланс массы в полной ячейке был зафиксирован так, чтобы анод имел емкость на 10% больше, чем катод.
Электрохимические исследования проводили при 20 ° C ± 2 ° C с использованием тестера аккумуляторов Maccor Series 4000.После 5 циклов формирования при С / 10 клетки подвергали циклической работе при 1 ° С в течение 500 циклов в диапазоне напряжения на ячейке от 3 В до 4,2 В для графитовых полных ячеек. Делитирование (= заряд) катода выполняли с помощью этапа зарядки постоянным током, за которым следовала дополнительная операция зарядки с постоянным напряжением при верхнем напряжении EOC полной ячейки до тех пор, пока ток не упал ниже C / 100. В качестве шага разряда применялся постоянный ток при 1С. Литиевый электрод сравнения использовался для контроля отдельных потенциалов LCO (рабочий электрод) и графита (противоэлектрод) отдельно друг от друга.
Исследования удельной поверхности по БЭТ проводили с использованием анализатора ускоренной площади поверхности и порозиметрии (ASAP 2020, Micrometrics Instrument Corporation). Перед анализом образцы дегазировали при 443 К и 1 мбар.
Базовая модель: Как потеря Li на аноде приводит к перезарядке на катоде?
Материал электрода и характеристики аккумуляторного элемента зависят от термодинамических параметров (например, емкости электрода и элемента, потенциала и напряжения) и кинетических факторов (например,г., скоростные и силовые характеристики). В общем, сочетание обоих аспектов в конечном итоге повлияет на общую производительность соты.
Верхнее напряжение отсечки (определяемое как разность между потенциалом отсечки катода LCO и потенциалом отсечки графитового анода) составляет 4,2 В и обозначено вертикальной стрелкой (рис. 3). Поскольку графитовый анод имеет потенциал ок. 65 мВ по сравнению с Li / Li + 51 в конце заряда катодный потенциал должен составлять ок. 4,265 В, т. Е. 4,2 В, положительное по отношению к потенциалу графита.На практике потеря емкости будет происходить из-за образования SEI на аноде, в частности, во время первой зарядки, но также и во время последующих циклов. Из-за потерь Li на аноде SEI графитовый электрод больше не может быть полностью литиирован (= заряжен), как в предыдущих циклах. Следовательно, параллельно с более низкой емкостью заряда анодный потенциал перемещается вверх, а также потенциал катода, чтобы поддерживать определенное верхнее напряжение отсечки ячейки на уровне 4,2 В. Пока есть дальнейшие потери Li, анодный потенциал перемещается дальше. до более положительных потенциалов, а также катодный потенциал, т.е.е. общее окно напряжения элемента EOC смещается вверх, на что указывают стрелки, перемещающиеся вверх по оси потенциалов и влево (= для уменьшения емкости) по оси емкости.
Увеличить Уменьшить Сбросить размер изображения
Рис. 3. Схема , показывающая сдвиг окна напряжения в литий-ионной полной ячейке с использованием катода LCO и графитового анода, вызванный необратимой потерей лития на аноде.
Любой катодный материал, который чувствителен к перезаряду и где начальный потенциал EOC близок к потенциалу, при котором происходит перезаряд, рискует столкнуться с условиями перезаряда из-за механизмов, описанных на рисунках 2 и 3.Когда реакция перезаряда приводит к деградации материала катода, это приводит к дальнейшей потере емкости. Это, в свою очередь, приводит к еще более быстрому смещению окна напряжения в сторону более высоких потенциалов: деградация катода из-за потери емкости — это самоускоряющийся процесс, происходящий как на аноде, так и на катоде.
Ниже мы покажем экспериментальные результаты, подтверждающие предложенный механизм.
Влияние удельной поверхности анода
Помимо используемого электролита, 33,52 степень образования SEI зависит от удельной поверхности графита. 34,35,53,54 Два графита от Timcal с разной площадью поверхности были развернуты в полных ячейках LCO / графит. Графит КС6 с большей площадью поверхности 20,52 м 2 г -1 и графит Т44 с меньшей площадью поверхности 9,78 м 2 г -1 .
На рис. 4a сравниваются удельная емкость и циклические характеристики катода LCO в полных ячейках с графитами T44 и KS6, соответственно. Емкость ячейки ограничена емкостью катода, так как анод был собран с 10% избыточной емкости.Полные ячейки показывают сильное снижение емкости в начальных циклах. После 25 циклов можно наблюдать постоянный линейный спад емкости. Поскольку необратимая емкость связана с потерей лития на аноде SEI 35,54 (и литий вытекает из катода), в полной ячейке уменьшение емкости катода LCO происходит быстрее, когда графитовый анод KS6 с большой площадью поверхности используется. Из-за того, что эффективность разряда / заряда <100%, в частности, в первых циклах, в каждом цикле наблюдается «потеря эффективности».Эта «потеря эффективности» рассчитывается следующим образом: КПД определяется как отношение разрядки C Dis , n к емкости заряда C Chg , n (в%). А «потеря эффективности» определяется как: 100% минус эти значения эффективности. На фиг. 4b потери эффективности интегрированы по количеству циклов разрядки / зарядки, то есть потеря эффективности в цикле № 1 добавляется к потере эффективности в цикле № 2 и так далее.Результирующие «Накопленные потери эффективности» S n наносятся на график в зависимости от номера цикла n в соответствии с уравнением 1 (см. 55 ).
Как и ожидалось, графит T44 с малой площадью поверхности имеет гораздо меньшую потерю эффективности, чем графит KS6 с большой площадью поверхности. В частности, во время продолжительного цикла может быть определено снижение коэффициента потери эффективности.
Увеличить Уменьшить Сбросить размер изображения
Рисунок 4. a) Стабильность цикла и b) Суммарные потери эффективности катода LCO в зависимости от удельной поверхности графитового анода (T44 с площадью поверхности 9,78 м 2 г -1 и KS6 с площадью поверхности 20,52 м 2 г −1 ). Циклы двухэлектродных полных ячеек проводили с 1M LiPF 6 в электролите EC: DMC 1: 1 (по массе) в диапазоне напряжений от 3,0 В до 4,2 В со скоростью 1 ° C после 5 циклов формирования со скоростью документа С / 10.
Согласно моделям, описанным на рисунках 2 и 3, потери Li на аноде приводят к увеличению потенциала конца заряда (EOC) на катоде.На рис. 5 показано, как потенциал ЭОС катода развивается при длительном циклировании до 500 циклов. В течение первых 100 циклов потенциал EOC LCO одинаков для обоих графитовых анодов, примерно приближаясь к 4,28 В по сравнению с Li / Li + , что близко к 4,265 В по сравнению с Li / Li + , упомянутым выше. Это указывает на то, что в течение первых 100 циклов потенциал EOC обоих графитовых анодов достигает минимального значения, которое соответствует соединению интеркаляции графита со стадией 1.Во время длительной езды на велосипеде между двумя графитами развиваются значительные различия. В случае графита T44 с меньшей площадью поверхности, потенциал EOC LCO остается постоянным в течение ок. 350 циклов. В течение последних 150 циклов видно медленное увеличение потенциала EOC. Напротив, с анодом KS6 с большей площадью поверхности, потенциал EOC LCO начинает быстро расти после всего лишь 100 циклов и выравнивается с положительным потенциалом 28 мВ до 4,28 В по сравнению с Li / Li + после 500 циклов заряда / разряда. .Эта разность потенциалов близка к разнице в 30 мВ между соединениями интеркаляции лития-графита на стадии 2 (LiC 12 ) и стадии 1 (LiC 6 ), описанной, например, в работе. 51.
Увеличить Уменьшить Сбросить размер изображения
Рис. 5. Потенциалы конца заряда (EOC) катода LCO в зависимости от количества циклов в зависимости от удельной поверхности графитового анода (T44 с площадью поверхности 9.78 м 2 г −1 и КС6 с площадью поверхности 20,52 м 2 г −1 ). Циклы двухэлектродных полных ячеек проводили с 1M LiPF 6 в электролите EC: DMC 1: 1 (по массе) в диапазоне напряжений от 3,0 В до 4,2 В со скоростью 1 ° C после 5 циклов формирования со скоростью документа С / 10.
Таким образом, при использовании в качестве материала анода графита KS6 с большой площадью поверхности потеря лития на аноде и увеличение потенциала EOC на катоде LCO происходят раньше и быстрее, чем при использовании графита T44.Следовательно, уменьшение емкости происходит быстрее, а условия перезаряда на катоде достигаются раньше и быстрее с KS6. Использование графита с малой площадью поверхности не только приводит к меньшему снижению емкости, но также и к более длительному циклированию до того, как на катоде LCO будут достигнуты неблагоприятные для рабочих характеристик и безопасности условия.
Влияние добавки к электролиту, формирующей анод SEI
Эффективной мерой для уменьшения степени реакций образования SEI и, следовательно, потерь лития на графитовом аноде является использование пленкообразующих добавок к электролиту, таких как виниленкарбонат (VC ).
Рис. 6 иллюстрирует сильное положительное влияние ВК как SEI, образующей анодную добавку, на характеристики катода LCO. На рис. 6а показано циклическое поведение полных ячеек в электролитах с добавлением VC и без него. В этих экспериментах в качестве анода использовался тот же графитовый материал. С VC как стабильность при циклическом воздействии, так и удельная емкость LCO выше, чем без добавки. Более низкая скорость замирания емкости LCO в присутствии VC может быть объяснена меньшей иммобилизацией лития (= меньшими потерями Li) в анодном SEI.Эта интерпретация подтверждается результатами, показанными на рис. 6b, показывающими, что суммарные потери эффективности на аноде намного выше в электролите без добавки ВК.
Увеличить Уменьшить Сбросить размер изображения
Рис. 6. Влияние 2 мас.% Виниленкарбоната (ВК) в 1 M LiPF 6 , EC: DMC 1: 1 (мас.) На а) характеристики цикла, б) суммарные потери эффективности в) потенциалы EOC полной графитовой ячейки LCO / T44.Ячейки циклически переключались в диапазоне напряжений от 3,0 В до 4,2 В со скоростью 1 ° C после 5 циклов формирования со скоростью C / 10.
Очевидно, что добавление VC к электролиту приводит к процессу образования SEI, при котором расходуется меньше Li (см. Обсуждение во вводной главе). Уменьшение потерь Li в присутствии добавки к электролиту положительно влияет на изменение потенциала EOC в зависимости от номера цикла (рис. 6c). Потенциал EOC остается на более низких значениях и почти постоянным во время цикла, когда присутствует VC, так как после 500 циклов увеличения потенциала EOC не наблюдается.Мы хотели бы подчеркнуть, что ВК может иметь дополнительный прямой положительный эффект в качестве добавки к электролиту на катоде, хотя здесь мы обсуждаем только прямое влияние на анод (и косвенное влияние на катод через анод).
Влияние кинетики электродов и сопротивления системы элементов
Явления, обсуждаемые до сих пор, являются результатом не только термодинамики, но и кинетики. Перенапряжения на обоих электродах, а также омическое сопротивление компонентов элемента неизбежно влияют на форму и абсолютное значение потенциальных кривых анода, катода и, таким образом, на результирующую кривую напряжения элемента, когда ток течет через элемент.Изменения кинетики электрода и сопротивления ячейки зависят от изменений химического состава ячейки во время цикла. Как на аноде, так и на катоде, новые фазы, такие как SEI (= новая межфазная поверхность на аноде) и новая межфазная поверхность катода, образуются и растут во время циклического заряда / разряда. Формирование последней межфазной границы можно объяснить следующим образом: потеря Li на аноде приводит к перезарядке LCO-катода (см. Обсуждение выше). Внешняя сфера LCO превращается в фазу шпинели во время цикла. 22 Эта фаза шпинели, как известно, имеет более медленную кинетику, чем гексагональный LCO. 56 При образовании межфазных границ на аноде и катоде не только расходуется подвижный литий, но межфазные границы представляют собой дополнительное сопротивление для транспорта Li + 57 , и, таким образом, потенциальные кривые изменяются по сравнению со сценарием, в котором такого нет. кинетические эффекты будут иметь место. На рис. 7 показаны типичные кривые потенциала заряда / разряда как катода, так и анода на различных стадиях жизненного цикла, т.е.е., на 1-м, 25-м и 500-м цикле. Форма и длина кривых потенциала катода сильно зависят от номера цикла. С увеличением номера цикла кривая LCO перемещается в сторону более высоких потенциалов для процесса заряда и более низких потенциалов для процесса разряда. Как показывает опыт, кривая потенциала при разряде смещается намного сильнее, чем при зарядке во время цикла. И, как и ожидалось, этот эффект сильнее для полной соты на базе KS6, чем для полной соты на базе T44. Это указывает на то, что потенциальная кривая катода и то, как она развивается во время циклирования, зависит от типа материала анода.По аналогии, графит KS6 также сильнее влияет на изменение кривых потенциала разряда во время циклирования, чем графит T44. Сосредоточившись на кривой потенциала анода, на рис. 8 сравниваются профили ячеек на основе KS6 и T44 в разрезе рис. 7. Очевидно, что потенциал анода не сильно меняется в своем абсолютном значении. Рисунок 8 дополнительно подтверждает утверждения, постулируемые на рисунке 3: можно вычислить явное снижение емкости, которое ингибирует литиирование графита и, таким образом, приводит к сокращению нижнего плато интеркаляции графита.
Увеличить Уменьшить Сбросить размер изображения
Рис. 7. Кривые потенциала заряда и разряда LCO / графитовых ячеек анода и катода в зависимости от использования различных графитов. Показаны три цикла, чтобы изобразить изменение потенциального профиля в течение срока службы. Это испытание проводилось с использованием 1 M LiPF 6 в электролите EC: DMC 1: 1 (по массе) в диапазоне напряжений от 3 В до 4.2 В при 1С на 495 циклов и 5 начальных циклов формирования при С / 10.
Увеличить Уменьшить Сбросить размер изображения
Рис. 8. Подробный вид трех характерных кривых анодного потенциала (1 st , 25 th и 500 th цикл) T44 и LCO / графитовой ячейки на основе KS6 (вырез на рис. 7).
Наблюдаемые сдвиги потенциала во время заряда и разряда элемента являются как результатом потери Li на графитовом аноде, так и повышенного сопротивления во всем элементе (см.также Таблица I). Инкрементное сопротивление R add было рассчитано с использованием приложенного тока I 1C во время цикла со скоростью 1C по следующему уравнению:
, где U 1 st — потенциал с начального первого плато кривой заряда LCO при емкости 1 мАч −1 (рис.5) и U n с (6 ⩾ n ⩾ 505) — потенциал следующих циклов при том же значении мощности.
Это означает, что рассчитанное сопротивление включает проблемы перенапряжения, а также дополнительные воздействия, такие как образование межфазных слоев, фазовые переходы и другие паразитные реакции.
На рис. 9 показано увеличение катодного сопротивления при циклировании по отношению к первому циклу, рассчитанное по потенциалу LCO, при котором была поставлена емкость 1 мАч g -1 (см. Объяснение выше). В хорошем соответствии с потенциальными кривыми EOC на рис. 3, наименьшее увеличение сопротивления было обнаружено, когда графит T44 с низкой поверхностью работал в электролите с 2% VC, а затем элемент на основе T44 без добавки электролита.Элемент на основе KS6 с электролитом без добавки демонстрирует наиболее сильное увеличение сопротивления, которое примерно вдвое выше, чем у элемента на основе T44.
Увеличить Уменьшить Сбросить размер изображения
Рис. 9. Увеличение сопротивления на полных катодных ячейках LCO с добавкой электролита (VC) и без нее и в зависимости от двух различных графитов, KS6 и T44. Ячейки циклически менялись в электролите EC: DMC 1: 1 (по массе) 1M LiPF 6 в диапазоне напряжений от 3.От 0 В до 4,2 В при 1 ° C, но первые 5 циклов выполнялись при скорости тока C / 10.
Поскольку кривая потенциала катода сдвигается намного быстрее и в большей степени, чем кривая потенциала анода (рис. 8), можно сделать вывод, что образование межфазной границы на катоде LCO определяет увеличение сопротивления. Это согласуется с Ref. 8.
В конце мы кратко обсудим влияние графитовых анодов с различной площадью поверхности на конечный разрядный потенциал (EOD) катода LCO (рис.10) Можно найти сходство с предыдущим обсуждением. Во-первых, графит KS6 вызывает более быстрое уменьшение значений катодного потенциала EOD, чем графит T44. Во-вторых, потенциалы EOD катода в целом ниже, чем у T44. Это указывает на более высокое и быстрое увеличение сопротивления на катоде, когда KS6 используется в качестве анода.
Увеличить Уменьшить Сбросить размер изображения
Рисунок 10. Потенциалы конца разряда (EOD) катода LCO в зависимости от используемого графита (большая площадь поверхности KS6 и низкая площадь поверхности T44). Ячейки подвергали циклическому воздействию при 1 ° C в диапазоне напряжений от 3 В до 4,2 В в электролите LiPF 6 EC: DMC 1: 1 (по массе) с 5 начальными циклами со скоростью C / 10.
В общем, значения потенциала EOD на катоде LCO показывают в четыре раза большее изменение, чем значения потенциала EOC во время цикла. Абэ и Огуми 58 обнаружили, что десольватация Li + в электролите является определяющим скорость процессом на графитовом аноде во время заряда.На катоде во время разряда происходит десольватация Li + , что может способствовать наблюдаемым, более выраженным изменениям потенциалов EOD.
LiCoO 2 (LCO) / графитовые полные элементы демонстрируют снижение производительности во время циклического заряда / разряда с верхним пороговым напряжением 4,2 В. Из-за потерь лития на / в анодном SEI графитовый электрод больше не может работать. так же полностью литиирован, как и в предыдущих циклах. Следовательно, во время циклирования, параллельно с более низкой емкостью заряда, потенциал анода перемещается вверх, так же как и потенциал катода, чтобы поддерживать предварительно определенное верхнее напряжение отсечки ячейки, равное 4.2 В. В результате катод LCO перезаряжается. В дополнение к потере Li и сдвигу потенциала EOC на катоде во время циклирования может наблюдаться увеличение сопротивления катода, что также отрицательно сказывается на сроке службы. Графитовый анод с меньшей площадью поверхности и добавка к электролиту, образующая SEI, такая как VC, могут помочь снизить потери Li на аноде и, таким образом, продлить срок службы элемента.
Поскольку потеря Li на аноде приводит к перезарядке катода LCO, что приводит к производительности и более важным проблемам безопасности, окончание срока службы (EOL) элемента необходимо определять на достаточно раннем этапе жизненного цикла, чтобы избежать возникновения условий перезарядки катода. в реальной проблеме безопасности.Обычно EOL литий-ионного элемента достигается, когда во время цикла достигается 80% (иногда ниже) номинальной емкости элемента. Другими словами, ячейка считается «мертвой», хотя 80% емкости все еще доступно. Относительно высокая остаточная емкость «мертвых» ионно-литиевых элементов побуждает задуматься о повторном использовании этих элементов через «вторую жизнь» в менее требовательных приложениях, то есть повторное использование элементов электрического транспортного средства в стационарных (сетевых) приложениях. Результаты нашей работы показывают, что такая попытка жизни 2 nd будет зависеть от химического состава ячейки, в частности от типа катода.
Описанные эффекты особенно важны для катодных материалов, чувствительных к перезарядке, и для анодов, которые нуждаются в защитном SEI и, следовательно, необратимо потребляют литий. Когда анодные материалы, такие как Li 4 Ti 5 O 12 (которые работают в основном за пределами региона SEI) и устойчивые к перезарядке катодные материалы, такие как Li M PO 4 (M = Fe, Mn и т. .), описанные механизмы менее выражены, что обеспечивает долгий цикл жизни ячеек с этими материалами.Другие меры противодействия включают: более качественные (с меньшим потреблением лития) компоненты электролита и добавки к электролиту, такие как VC или более низкое напряжение отсечки (как это делается в гибридных электромобилях (HEV) и электромобилях (EV)), которые, как известно, имеют длительный цикл. жизнь.
Все результаты указывают на исследовательский подход, который рассматривает все взаимодействия и реакции анодов с электролитами и катодами, происходящие в ячейке, таким образом, целостный системный подход. Чтобы улучшить характеристики катода, потери Li на аноде, в основном из-за реакций с электролитом, должны быть уменьшены или, в лучшем случае, даже устранены.
Мы с благодарностью благодарим Robert Bosch GmbH через Hans L. Merkle Stiftung и Федеральное министерство образования и исследований Германии (BMBF) за финансирование. Мы с благодарностью отмечаем поставку графитового анодного материала фирмой Timcal Switzerland и LiCoO 2 фирмой Toda Advanced Materials Inc.
Понимание различных значений при измерениях электролита
ПРОБА КРОВИ
Для обсуждения двух технологий в первую очередь используется для измерения электролитов необходимо уточнить какая часть крови используется для измерения.
Образец цельной крови состоит из общей плазмы и эритроциты. Общая плазма состоит из водной фазы и ряда из твердых компонентов, состоящих из белков и липидов. Обычно твердые частицы в плазме составляют прибл. 7% от общего объема плазмы. Вода составляет 93%. См. Рис.1.
| РИС. 1 |
Электролиты присутствуют в плазме только вода , и это то, что тело отвечая на.Таким образом, это фактически только плазма. вода, представляющая интерес для измерения электролиты.
Одна измерительная техника реагирует на содержание электролита в плазменная вода (прямая ISE), а другая (непрямая ISE) реагирует к содержанию электролита в объеме общей плазмы. Тем самым распределение между водой и твердой фазой важно, так как содержание белков и липидов может отличаться от нормы и будет вызывают разницу в сообщаемых результатах двух разных измерительные технологии.
Технология, используемая для измерения электролитов, отвечает к содержанию электролита в плазменной воде и отражает физиологической ситуации, тем самым давая наиболее полезный результат для врач, на которого нужно действовать. Эта технология называется прямой ISE.
ИЗМЕРИТЕЛЬНЫЕ ТЕХНОЛОГИИ
Две разные технологии, используемые для измерение электролитов названо по-разному в литература; однако наиболее часто используемые имена: прямой ISE и косвенный ISE .ISE означает ионоселективные электроды.Косвенный ISE:
- Измерения всего образца плазмы (или сыворотки), который был разбавляется большим объемом разбавителя.
- Требует, чтобы плазма и эритроциты были разделены центрифугирование.
- Из-за разбавления этот метод измеряет среднее концентрация в плазме, т.е. средневзвешенное значение между концентрация в водной части, содержащей электролит, и в белковая / липидная часть, не содержащая электролитов.Концентрация рассчитывается путем умножения результата на разведение фактор.
- Результаты сопоставимы с пламенной фотометрией.
- Эта технология обычно используется в крупных так называемых химические анализаторы в централизованной лаборатории.
- Сообщаемый результат зависит от содержания твердых веществ в образец.
Прямой ISE:
Меры на неразбавленном образце цельной крови или плазмы.Однако фактическое измерение выполняется на плазменной воды.
Когда используется цельная кровь, в ней не используются образцы подготовка.
Direct ISE фактически измеряет активность электролита в плазменная вода (ммоль / кг H 2 O), а не «концентрация в плазме (ммоль / л)». Электрохимический активность ионов в воде преобразуется в показания концентрации на фиксированный (специфичный для ионов) множитель.Это точен только для данной ионной силы, обычно выбираемой для равняется 160 ммоль / л для плазмы.
Использование этого фиксированного коэффициента гарантирует, что прямая ISE отражает фактическое, клинически соответствующая активность, независимо от уровня белков и / или липиды [2]. Это не меняет того факта, что результат традиционно называется «концентрацией».
Это преобразование на основе рекомендаций Экспертной группы IFCC по pH и Газы крови и сделано во избежание путаницы наличие двух типов электролитов.
Эта технология обычно используется в анализаторах газов крови. и анализаторы электролита POC, и они могут быть размещены как в в лаборатории и в условиях стационара.
Сообщаемый результат не зависит от содержания твердых частиц. в образце.
В заключение, результаты двух разных типов анализатор доведен до корреляции образцов с нормальным содержанием белков и липидов.Это, конечно, требует, чтобы все преаналитические и аналитические вариации исключены.
ОБРАЗЦЫ С НОРМАЛЬНЫМ СОДЕРЖАНИЕМ БЕЛКОВ / ЛИПИДОВ
Вариация содержания белков и липидов из нормальной ситуации вызовет ошибку в сообщенном электролит возникает в результате непрямого ИСЭ.
В литературе сообщается, что погрешность меньше 5 % при концентрации триглицеридов менее 2500 мг / дл (рекомендуемый уровень 35–160 мг / дл) [3].Влияние ошибок на измерение электролитов относится ко всем электролитам; однако наиболее ярко это проявляется в отношении натрия.
Примеры ошибок на натрия из литературы: ошибка 17 ммоль / л [4] сообщили с повышенным содержанием белка и ошибкой 26 ммоль / л [4] из-за повышенного содержания липидов.
Когда твердое содержание отклоняется от нормы, обычно увеличивается, и тогда типичными типами ошибок являются:
- Концентрация электролита отображается как нормальная или низкая, когда на самом деле она опасно высока, или
- Сообщается, что концентрация электролита слишком низкая, когда она на самом деле нормально.
Последнее явление также называется псевдогипонатриемией, при которой натрий обеспокоен.
Повышенное содержание белков и липидов имеет место в течение длительного список распространенных заболеваний, таких как диабет, печень и почечные синдромы, алкоголизм и т.д. врачам к опасным для жизни ошибочным выводам и следует поэтому следует принимать во внимание при оценке электролита. результаты, полученные с помощью косвенной технологии ISE.
Приложение A дает более подробное объяснение с фактическим пример разницы между отчетными результатами прямого и косвенная технология ISE.В Приложении B приведен метод того, как рассчитать разницу для данного объема твердых тел.
ПРИЛОЖЕНИЕ A — ПРИМЕР
Как упоминалось ранее, косвенная ISE измеряет средняя концентрация электролитов в плазме, т.е. взвешенная среднее значение между концентрацией электролитсодержащего вода и белок / липид без электролитов. Как следствие это сообщаемое значение будет зависеть от уровня белка / липидов. Это не относится к прямому ISE, который измеряет электролит. активность в водной части плазмы.
В таблице I это проиллюстрировано на примере.
Сравниваются три образца:
- Образец A (типичный калибровочный раствор) состоит только из вода, рис. 2.
| РИС. 2 |
- Образец B (нормальный образец плазмы взрослого) состоит на 93% вода и 7% липидов / белков, рис. 3.
| РИС.3 |
- Образец C (плазма с повышенным уровнем липидов) имеет объем белков / липидов равен 15%. Рис. 4.
| РИС. 4 |
Только вода содержит электролиты, и вся вода одинакова концентрация электролитов независимо от того, есть ли в воде часть образца A, B или C; т.е. все три образца имеют одинаковые уровень физиологически.
В таблице перечислены объемы и концентрации применительно к объем образца 100 мкл. Концентрация натрия в воде был установлен на уровне 150 ммоль / л = 150 нмоль / мкл воды.
Электроды прямого ИСЭ, калиброванные на водных растворах (и без особых исправлений) сообщают о концентрации ионы в водной части. В этом случае они сообщают о 150 нмоль / мкл воды. для всех трех образцов, что отражает тот факт, что натрий концентрации (активности) в трех частях воды равны.
Разбавление включает взятие определенного объема всей пробы, не только воды, добавив к ней разбавитель перед полученная смесь отмеряется. Общее количество натрия количество ионов / атомов в образце затем выражается как среднее концентрация в общем объеме исходной пробы.
Как Вследствие этого указанные значения зависят от уровень белков / липидов в образцах.
Описание образца и состав | А | B | С |
Общий объем образца (мкл) | 100 | 100 | 100 |
Объем липидов / белков (мкл) | 0 | 7 | 15 |
Объем воды (мкл) | 100 | 93 | 85 |
c Na + в воде (нмоль / мкл) | 150 | 150 | 150 |
Общее количество Na (нмоль) в образце | 15000 | 13950 | 12750 |
Среднее значение c Na + в выборке
(нмоль / мкл) | 150.0 | 139,5 | 127,5 |
ТАБЛИЦА I
Сравнение прямых результатов ИСЭ и метода разбавления результаты показывают, что разница увеличивается с увеличением громкости белка / липида, не содержащего электролиты. Это также иллюстрирует что невозможно исправить результаты, чтобы согласовать с каждым другое, если относительный объем воды не определен для каждый образец.
ПРИЛОЖЕНИЕ B — КАК РАССЧИТАТЬ РАЗНИЦУ ДЛЯ ДАННЫХ ОБЪЕМ ТВЕРДЫХ
Согласно вышеприведенному плану, главный фактор определение величины разницы — относительный объем белка / липида в плазме. Показан упрощенный расчет в Таблице II.
Описание и состав образца | Плазма с | Плазма | |
Общий объем образца (мкл) | 100 | 100 | |
Объем липидов / белков (мкл) | 7 | х | |
Объем воды (мкл) | 93 | 100-х | |
c Na + в воде (нмоль / мкл) | 150 | 150 | |
Общая сумма Na + (нмоль) | 13950 | 150 × (100 — х) | |
Среднее значение c Na + в выборке (нмоль / мкл) | 139.5 | 150 × (100 — х) / 100 | |
Прямое значение ISE | Внутреннее значение | 150 | 150 |
Считывание | 139.5 | 139,5 | |
Метод разведения, отсчет | 139,5 | 150 — 1,5 × x | |
Разница (прямой ISE — непрямой ISE) | 0 | –10.5 + 1,5 × х | |
ТАБЛИЦА II Пример
В: Какова ожидаемая разница между результатами по натрия? от анализатора, использующего непрямой ISE, и анализатора, использующего прямой ISE для данной концентрации натрия 140 ммоль / л в плазме, если белок плазмы: а) 70 г / л (нормальный), б) 40 г / л (часто наблюдается в отделениях интенсивной терапии. пациенты) или c) 0 г / дл (видно в растворах для контроля качества или в проверке квалификации образцы)?
A: Уровни белка в плазме 70, 40 или 0 г / л соответствуют
ок.7, 4 или 0 об.% Соответственно. Если предположить, что липиды не
в настоящее время ожидаемые различия для cNa + (прямой ISE — косвенный
ISE) будет
а) в Na + = –10,5 + 1,5 ×
7 = 0
б) в Na + = –10,5 + 1,5 ×
4 = –4,5 (ммоль / л).
в) в Na + = –10,5 + 1,5 ×
0 = –10,5 ммоль / л. Для решений контроля качества анализатор с использованием непрямого ISE
сообщит значения, которые на 7% выше, чем у анализатора, использующего
прямой ISE.
| Мичиган Медицина
Обзор темы
Панель электролитов — это анализ крови, который измеряет уровни электролитов и углекислого газа в вашей крови.
Электролиты — это минералы, такие как натрий и калий, которые содержатся в организме. Они поддерживают баланс жидкостей вашего тела и помогают поддерживать нормальную работу вашего тела, включая сердечный ритм, сокращение мышц и работу мозга.
В этом тесте также измеряется двуокись углерода (CO2). CO2 — это ненужный продукт, который образуется, когда организм расщепляет пищу для получения энергии (метаболизм). Он принимает форму бикарбоната в крови, поэтому эту часть теста иногда называют тестом на бикарбонат.Бикарбонат помогает вашей крови поддерживать правильный pH.
Ваш врач может назначить электролитную панель в рамках регулярного медицинского осмотра. Ваш врач может использовать этот тест для проверки или диагностики заболевания. Ваш врач также может использовать панель электролитов, чтобы увидеть, изменили ли какие-либо лекарства, которые вы принимаете, уровень электролитов.
Панель электролитов измеряет уровни углекислого газа, хлорида, калия и натрия в крови.
Список литературы
Консультации по другим работам
- Chernecky CC, Berger BJ (2013).Лабораторные исследования и диагностические процедуры, 6-е изд. Сент-Луис: Сондерс.
- Fischbach FT, Dunning MB III, ред. (2009). Руководство по лабораторным и диагностическим исследованиям, 8-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс.
- Pagana KD, Pagana TJ (2010). Руководство Мосби по диагностическим и лабораторным исследованиям, 4-е изд. Сент-Луис: Мосби.
Кредиты
По состоянию на 23 сентября 2020 г.
Автор: Healthwise Staff
Медицинский обзор: E.Грегори Томпсон, доктор медицины — внутренние болезни
Адам Хусни, доктор медицины — семейная медицина
Мартин Дж. Габика, доктор медицины — семейная медицина
По состоянию на: 23 сентября 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E. Грегори Томпсон, врач внутренних болезней и Адам Хусни, доктор медицины, семейная медицина и Мартин Дж. Габика, доктор медицины, семейная медицина
Использование тестов на утечку электролита для определения подъемных окон и обнаружения повреждения тканей
Использование тестов на утечку электролита для определения подъемных окон и обнаружения повреждений тканей | Treesearch Перейти к основному содержанию .gov означает, что это официально.
Веб-сайты федерального правительства часто заканчиваются на .gov или .mil. Прежде чем делиться конфиденциальной информацией, убедитесь, что вы находитесь на сайте федерального правительства.
Сайт безопасен.
https: // гарантирует, что вы подключаетесь к официальному веб-сайту, а любая предоставляемая вами информация шифруется и безопасно передается.
Первичная станция (и):
Исследовательская станция Скалистых гор
Источник:
В: Dumroese, R.К .; Riley, L.E .; Ландис, Т. Д., технические координаторы. Отечественные труды: ассоциации лесных и природоохранных питомников-1999, 2000, 2001. Известия РМРС-П-24. Огден, штат Юта: Лесная служба Министерства сельского хозяйства США, Исследовательская станция Скалистых гор. п. 12-14
Описание
Физиологические тесты быстро начинают использоваться как средство для определения состояния питомника и прогнозирования его реакции на лечение или использование.Один из таких тестов, тест на утечку электролита, можно использовать для измерения морозостойкости и обнаружения повреждения тканей. Принцип этого теста заключается в том, что при повреждении клеточных мембран электролиты просачиваются в воду, в которую погружена ткань, и их можно измерить по проводимости раствора. Тест на повреждение неспецифичен в том смысле, что все, что повреждает мембраны, например, холод, жара, болезнь или механическое повреждение, вызовет утечку электролита. В случае измерения морозостойкости мы знаем повреждающий агент, потому что мы замораживаем ткань.
Цитата
Тинус, Ричард В. 2002. Использование тестов на утечку электролита для определения подъемных окон и повреждения тканей. В: Dumroese, R.K .; Riley, L.E .; Ландис, Т. Д., технические координаторы. Отечественные труды: ассоциации лесных и природоохранных питомников-1999, 2000, 2001. Известия РМРС-П-24. Огден, штат Юта: Лесная служба Министерства сельского хозяйства США, Исследовательская станция Скалистых гор.п. 12-14
Примечания к публикации
- Мы рекомендуем вам также распечатать эту страницу и прикрепить ее к распечатке статьи, чтобы сохранить полную информацию о цитировании.
- Эта статья была написана и подготовлена служащими правительства США в официальное время и поэтому находится в открытом доступе.

 Химия, 8–9 класс.
Химия, 8–9 класс. К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.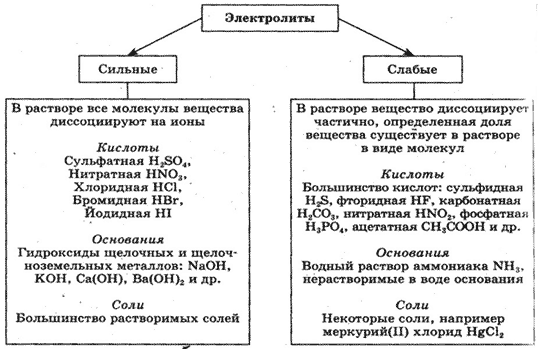
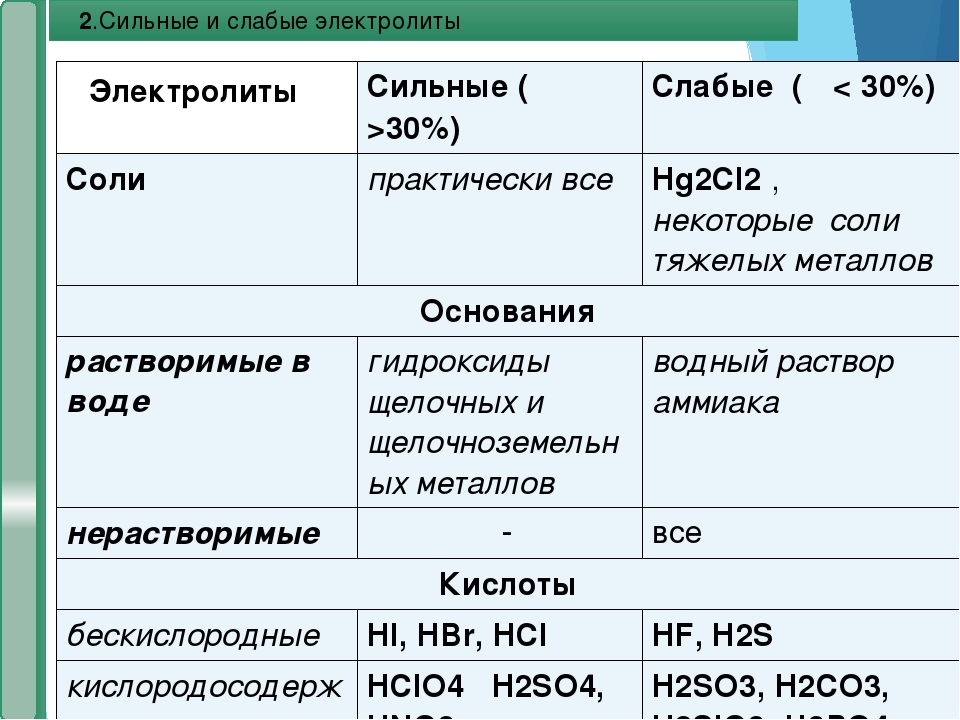 В качестве неэлектролита может выступать вода.
В качестве неэлектролита может выступать вода.