Принцип работы катализатора в автомобиле
На чтение 3 мин. Просмотров 1k.
Большинство автолюбителей даже не имеют представление о том, что такое автомобильный катализатор и в чем заключается принцип его работы. Именно поэтому сегодня мы попытаемся рассказать что это такое катализатор автомобильный.
Машины являются одним из самых крупных источников загрязнений атмосферы, так как они выбрасывают в атмосферу около 15 000 химических соединений, к которым относится газ и пыль. Компании по производству автомобилей постоянно стараются уменьшить количество вредных выбросов, именно это и привело к созданию автомобильного каталитического нейтрализатора системы выхлопа или как его еще называют катализатор.
Катализатор входит в состав выхлопной системы автомобиля и предназначается для понижения уровня выбросов вредоносных веществ вместе с продуктами горения.
Катализатор автомобильныйВ представленной статье мы более подробно поговорим о катализаторе, а именно обсудим такие вопросы:
- Что такое автомобильный катализатор?
- Конструкция автомобильного катализатора;
- В чем заключается принцип работы?
- Распространенные поломки каталитического нейтрализатора, при которых необходима его полная замена;
- Признаки неисправности, указывающие на то, что необходима замена;
- Как правильно проводится замена каталитического нейтрализатора выхлопной системы?
Основная информация о каталитическом нейтрализаторе
Большинство автолюбителей даже не имеют представления о том, что такое автомобильный катализатор и в чем заключается принцип его работы.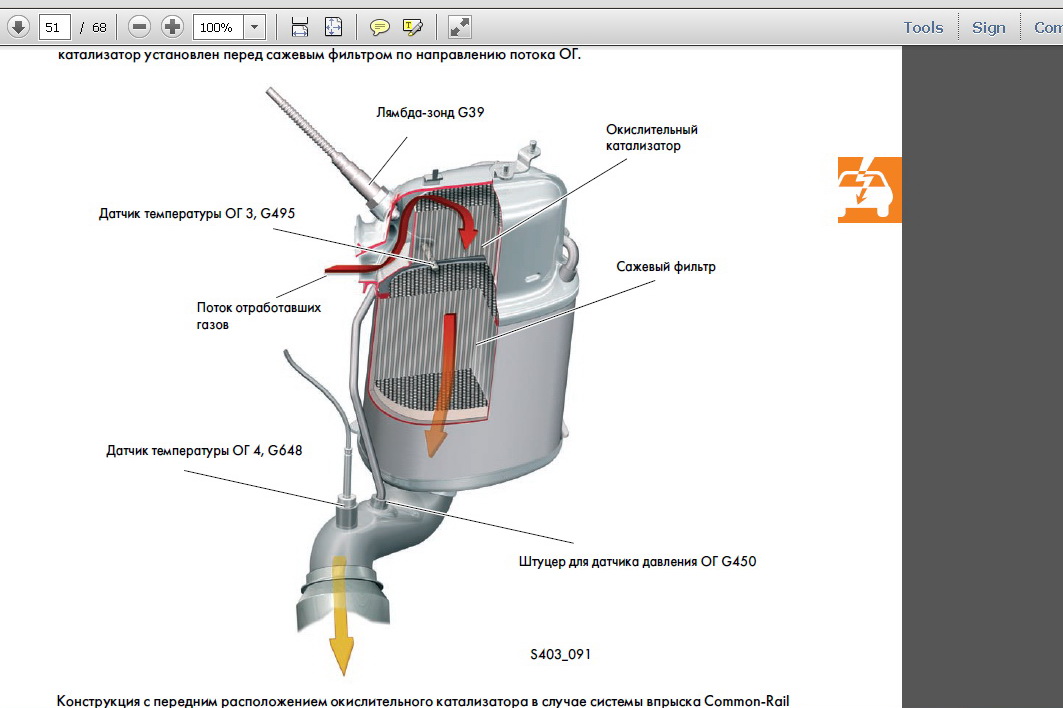 Именно поэтому сегодня мы попытаемся рассказать основную информацию о каталитическом нейтрализаторе. Итак, автомобильный нейтрализатор это элемент выхлопной системы транспортного средства, снижающий температуру выхлопных газов, очищающий выхлопные газы и обеспечивающий догорание топливной смеси.
Именно поэтому сегодня мы попытаемся рассказать основную информацию о каталитическом нейтрализаторе. Итак, автомобильный нейтрализатор это элемент выхлопной системы транспортного средства, снижающий температуру выхлопных газов, очищающий выхлопные газы и обеспечивающий догорание топливной смеси.
Схема катализатора автомобильногоКаталитический нейтрализатор используется на бензиновых и дизельных двигателях автомобиля. Представленное устройство чаще всего располагается за коллектором выпускной системы или же перед глушителями.
Основными элементами катализатора являются: теплоизоляция, корпус и блок-носитель. На сегодняшний момент существует несколько видов нейтрализаторов, которые соответствуют разному содержанию выхлопных газов в автомобильном двигателе.
К основным типам автомобильного катализатора выхлопной системы относятся: восстановительный, окислительный и окислительно-восстановительный.
Для правильной замены каталитического нейтрализатора должны соблюдаться некие условия, для соблюдения этих условий применяется лямбда-зонд. Благодаря данному устройству посылается обновленная информация и регулируется состав топливной смеси.
Благодаря данному устройству посылается обновленная информация и регулируется состав топливной смеси.
Признаки неисправности, указывающие на то, что необходима замена
При нормальном функционировании катализатор ломается только после полного сгорания каталитического слоя. Такое формулирование даже не совсем правильно, так как он не ломается, а просто из-за уменьшения каталитического слоя он не может полностью сжигать выхлопные газы. То есть эффективность работы уменьшается, а токсичность продуктов горения повышается. Автомобильный катализатор достаточно редко выходит из строя, но все же каждый автолюбитель должен знать, как поступать в таком случае. Поэтому давайте рассмотрим, как проводится самостоятельная замена каталитического нейтрализатора.
Для начала давайте рассмотрим основные признаки неисправности каталитического нейтрализатора выхлопной системы:
- Снизилась мощность автомобиля, это свидетельствует о том, что нейтрализатор забит.

- Во время передвижения транспортного средства на холостых оборотах двигателя заметно плаванье стрелочки тахометра.
- И выхлопной трубки чувствуется запах аммиака.
Итак, как же правильно проводится замена катализатора?
- Открутите болтики, закрепляющие устройство на дополнительном глушителе;
- Снимите болтики вместе с шайбой;
- Открутите болтики, которые закрепляют устройство на приемной трубке;
- Достаньте болтики вместе с пружинными шайбами;
- Достаньте устройство под днищем автомобиля;
- ПРоведите замену и соберите все в обратном порядке.
Как видите, замена катализатора системы выхлопа довольно проста и с ней сможет справиться даже не очень опытный автолюбитель. Обратите внимание на то, что в момент функционирования он может нагреваться до температуры около 600 градусов. Поэтому прежде чем перейти к замене катализатора дождитесь полного его охлаждения.
com/embed/YQ-3NAzKP3A» frameborder=»0″ allowfullscreen=»allowfullscreen»/>
Катализатор. Принцип работы, назначение. Удаление или чистка
На протяжении многих лет авто производители создают много усовершенствований в автомобильных двигателях и топливных системах, чтобы идти в ногу со временем и, безусловно, с законами, направленными на улучшение экологической ситуации на фоне выбросов автомобилей. Одно из кардинальных таких усовершенствований произошло в 1975 году с интересным устройством под названием катализатор. По сути работа катализатора заключается в преобразовании вредных веществ в менее вредные выбросы, прежде чем они покинут выхлопную систему автомобиля.
Устройство и принцип работы каталитического нейтрализатора
В составе выхлопных газов автомобиля содержится довольно много токсичных веществ. Для предотвращения их попадания в атмосферу используется специальное устройство, получившее название «каталитический нейтрализатор» (более известный как «катализатор»). Он устанавливается на автомобилях, оснащенных двигателями внутреннего сгорания, работающих как на бензине, так и на дизельном топливе. Зная принцип работы катализатора, вы сможете понять важность его работы и оценить последствия, которые может вызвать его удаление.
Он устанавливается на автомобилях, оснащенных двигателями внутреннего сгорания, работающих как на бензине, так и на дизельном топливе. Зная принцип работы катализатора, вы сможете понять важность его работы и оценить последствия, которые может вызвать его удаление.
Конструкция и функции катализатора
Нейтрализатор является частью системы выхлопа. Он располагается сразу за выпускным коллектором двигателя. Катализатор состоит из:
- Металлический корпус (монтажный мат), имеющий входной и выходной патрубки.
- Керамический блок (монолит). Представляет собой пористую структуру с множеством ячеек, которые увеличивают площадь соприкосновения выхлопных газов с рабочей поверхностью.
- Каталитический слой — специальное напыление на поверхностях ячеек керамического блока, состоящее из платины, палладия и родия. В последних моделях для напыления иногда используется золото — драгоценный металл, который имеет более низкую стоимость.
- Металлический кожух.
 Выполняет функции теплоизоляции и защиты катализатора от механических повреждений.
Выполняет функции теплоизоляции и защиты катализатора от механических повреждений.
Главная функция каталитического нейтрализатора — это нейтрализация трех основных токсических компонентов отработавших газов, поэтому он получил свое название — трехкомпонентный. Вот эти нейтрализуемые компоненты:
- Окислы азота NOx – компонент смога, причина кислотных дождей, ядовиты для человека.
- Угарный газ СО – смертельно опасен для человека при концентрации в воздухе от 0,1%.
- Углеводороды CH – компонент смога, отдельные соединения канцерогены.
Принцип действия катализатора
На практике трехкомпонентный каталитический нейтрализатор имеет следующий принцип действия:
Выхлопные газы из двигателя попадают внутрь керамических блоков, где проникают в ячейки, полностью заполняя их.
Металлы-катализаторы палладий и платина провоцируют реакцию окисления, в результате которой несгоревшие углеводороды СН преобразуются в водяной пар, а угарный газ СО в углекислый.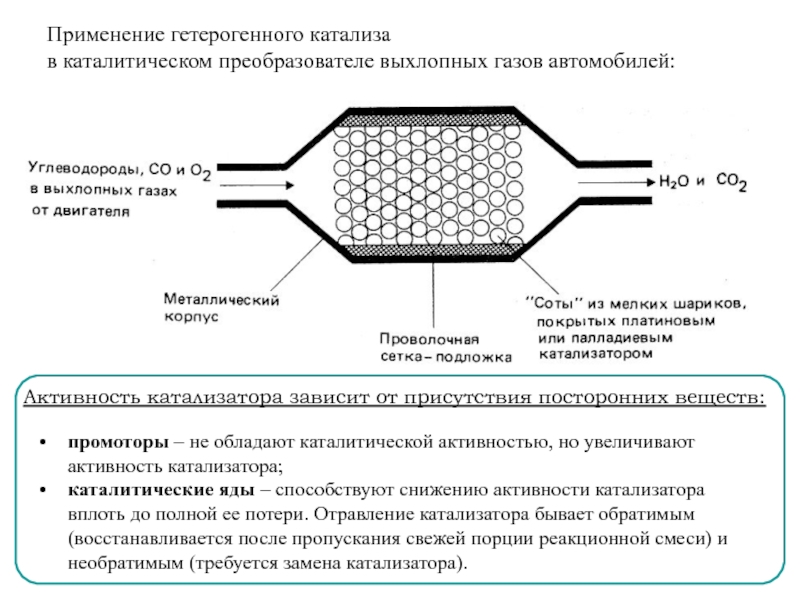
Восстановительный металл-катализатор родий преобразует NOx (оксид азота) в обычный безвредный азот. В атмосферу выпускаются очищенные отработавшие газы.
Если в автомобиле установлен дизельный двигатель, то возле катализатора всегда находится сажевый фильтр. Иногда эти два элемента могут быть совмещены в единую конструкцию. Рабочая температура катализатора играет решающую роль в эффективности процесса нейтрализации токсичных компонентов. Реальное преобразование начинается только после достижения 300°С. Идеальной, с точки зрения эффективности и срока службы, считается температура от 400 до 800°С. В диапазоне температур от 800 до 1000°С наблюдается ускоренное старение нейтрализатора. Длительная работа при температуре свыше 1000°С оказывает губительное воздействие на катализатор. Альтернативой керамике, выдерживающей высокие температуры, является металлическая матрица из гофрированной фольги. Катализаторами в такой конструкции выступают платина и палладий.
Что ценного в катализаторах
К сожалению, ценного там оказалось много. В роли катализаторов пришлось применить благородные металлы, наиболее подходящие для этой цели.
В роли катализаторов пришлось применить благородные металлы, наиболее подходящие для этой цели.
Дошло до того, что самым дешёвым из них оказалось золото, но чаще приходится использовать платину, палладий и родий. Многим известно, что эти элементы существенно дороже всем понятного золота.
Одновременно с применением столь недешёвых компонент потребовалось создать геометрически непростую структуру, обеспечивающую контактирование каталитического вещества со всем объёмом выпускаемого цилиндрами газа. Это мельчайшие керамические или металлические соты, сквозь которые и продувается весь поток выхлопа.
В результате автомобиль приобрёл сложное, массивное и дорогое устройство в виде металлического корпуса, высокотехнологичной начинки, да ещё и обрамлённое контрольными датчиками с двух сторон, непрерывно следящими за его сохранностью и правильной работой.
Экологичность даром не даётся. Да и на этом прогресс не остановился, дальнейшее ужесточение требований законодателей продолжает влиять на появление дополнительных систем очистки выхлопа.
В дизеле
Катализаторы в дизельном двигателе работают гораздо хуже в сокращении выбросов NOx. Одной из причин этого является то, что дизельные двигатели имеют более низкую рабочую температуру, чем бензиновые двигатели, и катализатор в целом в дизельном двигателе работает хуже, поскольку он меньше нагревается. Некоторые из ведущих экспертов экологических авто придумали новую систему, которая помогает бороться с этим. Они используют мочевину в решении этой проблемы: прежде чем оксиды азота уходят в катализатор, их принудительно испаряют и смешивают с выхлопом и затем создают химическую реакцию, которая приведёт к сокращению выбросов NOx. Мочевина, также известная как карбамид, представляет собой органическое соединение, изготовленное из углерода, азота, кислорода и водорода. Мочевина содержится в моче млекопитающих и земноводных. Мочевина реагирует с NOx, производя в результате реакции азот и водяной пар и утилизируя более 90 процентов оксидов азота в выхлопных газах.
Виды катализаторов
По своему назначению нейтрализатор может быть двух- или трехкомпонентным.
- В первом случае он выполняет относительно простые функции окисления (дожигания) угарного газа и углеводородов до образования воды и двуокиси углерода.
- Во втором – добавляется сложная способность устройства работать с окислами азота. Особенно много их образуется в современных дизельных и бензиновых моторах, в силу повышения экономичности, которых конструкторам приходится использовать обеднённые и бедные смеси на впуске.
Трёхкомпонентые катализаторы, а именно такие чаще всего применяются, в свою очередь, могут отличаться по конструктивному признаку, изготавливаясь на базе керамических или металлических сотовых изделий.
Керамические относительно дешевле, но не обладают высокой механической прочностью и долговечностью, склонны к растрескиванию и разрушению, не терпят ударов при наезде на препятствия.
Металлические конструктивы обладают достаточной упругостью, поэтому лучше держат внешние и внутренние удары. Внутренние могут возникать при аномальных процессах горения и разрушительно воздействовать на тонкую сотовую начинку, где, как уже упоминалось, обычно нанесены такие непростые вещества, как платина, палладий и родий.
Но даже металл не спасает от предательского попадания на тонкие соты посторонних веществ из двигателя в виде компонент контрафактных рабочих жидкостей, слишком богатой смеси или всевозможных соединений кремния.
Катализаторы отличаются и по способу их установки. Раньше они располагались в виде врезок выхлопной трубы, подобно глушителям и резонаторам. Но оказалось, что так их очень трудно и затратно прогревать до рабочей температуры, при которой начинаются каталитические реакции.
Поэтому сейчас нейтрализаторы ставят непосредственно за выпускным коллектором, максимально близко к точке выхода раскалённых выхлопных газов. Уже не надо долго ждать выхода прибора на режим, меньше загрязняются кислородные датчики и сокращаются расходы топлива на поддержание температуры.
Срок службы катализатора
Средний ресурс катализатора составляет 100 тыс. километров пробега, но при правильной эксплуатации он может исправно функционировать и до 200 тыс. километров. Основные причины раннего износа — неисправность двигателя и качество топлива (топливовоздушной смеси). При наличии обедненной смеси происходит перегрев, а при слишком богатой возникает засорение пористого блока остатками несгоревшего топлива, что препятствует протеканию необходимых химических процессов. Это приводит к тому, что срок службы каталитического нейтрализатора существенно снижается. Еще одной распространенной причиной неисправности керамического катализатора являются механические повреждения (трещины), возникающие при механических воздействиях. Они провоцируют быстрое разрушение блоков. При возникновении неисправностей работа каталитического нейтрализатора ухудшается, что фиксируется при помощи второго лямбда-зонда. В этом случае электронный блок управления сообщит о неисправности, выдав на приборной панели ошибку «CHECK ENGINE». Также признаками выхода из строя являются дребезжание, увеличение расхода топлива и ухудшение динамики. В этом случае его меняют на новый (оригинального производства или универсальный).
Основные причины раннего износа — неисправность двигателя и качество топлива (топливовоздушной смеси). При наличии обедненной смеси происходит перегрев, а при слишком богатой возникает засорение пористого блока остатками несгоревшего топлива, что препятствует протеканию необходимых химических процессов. Это приводит к тому, что срок службы каталитического нейтрализатора существенно снижается. Еще одной распространенной причиной неисправности керамического катализатора являются механические повреждения (трещины), возникающие при механических воздействиях. Они провоцируют быстрое разрушение блоков. При возникновении неисправностей работа каталитического нейтрализатора ухудшается, что фиксируется при помощи второго лямбда-зонда. В этом случае электронный блок управления сообщит о неисправности, выдав на приборной панели ошибку «CHECK ENGINE». Также признаками выхода из строя являются дребезжание, увеличение расхода топлива и ухудшение динамики. В этом случае его меняют на новый (оригинального производства или универсальный).
Можно ли удалить катализатор?
При удалении катализатора его очень часто заменяют на пламегаситель. Последний выравнивает поток выхлопных газов. Его установка рекомендуется для устранения неприятных шумов, которые возникают при удалении катализатора. При этом, если вы выбрали именно удаление, лучше полностью снять устройство и не прибегать к рекомендациям некоторых автомобилистов пробить в нем отверстие. Подобная процедура улучшит ситуацию только на время. В автомобилях, соответствующих экологическим стандартам Евро-3, помимо удаления катализатора необходима перепрошивка электронного блока управления. Ее обновляют до версии, в которой отсутствует каталитический нейтрализатор. Также можно установить эмулятор сигнала кислородного датчика, который избавит от необходимости перепрошивать ЭБУ.
Как почистить
В тех случаях, когда соты ещё не повреждены, но пропускная способность нейтрализатора уже снижена смолянистыми отложениями, его можно промыть.
Для этого лучше всего использовать жидкость, обычно применяемую для очистки карбюраторов или топливных форсунок. Только потребуется её значительно больше.
Катализатор заливается промывочной жидкостью, после чего ей предоставляется время на растворение загрязнений, затем её сливают, внутренности детали промываются горячей водой и просушиваются (продуваются).
Обычно процедура требует неоднократного повторения. Существуют также специально предназначенные для подобных промывок составы.
Источники: techautoport.ru, autovogdenie.ru, drive2.ru.
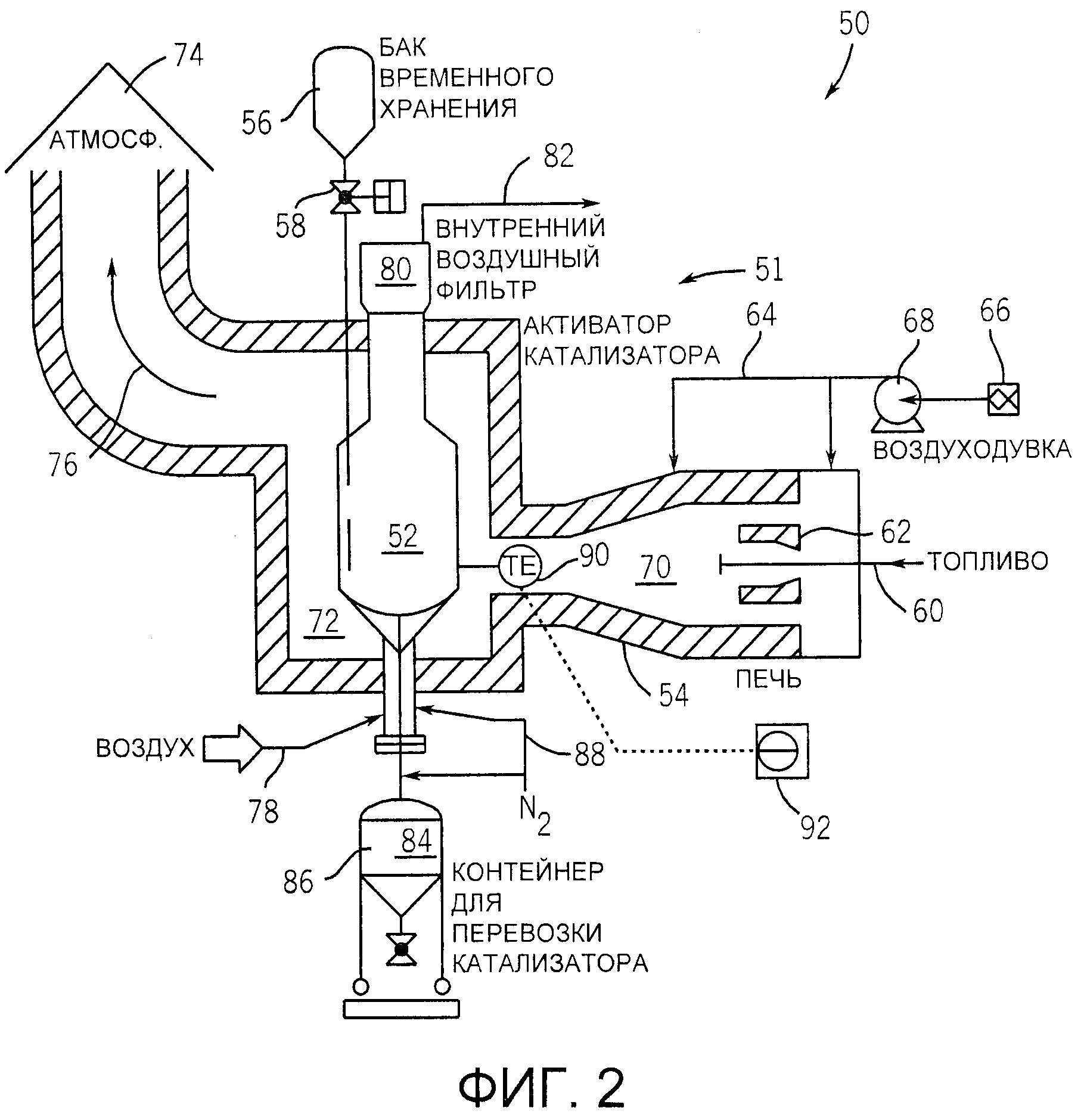
Принцип работы катализатора
Катализатор — как правильно работать?
Катализатор, также известный как каталитический нейтрализатор, является важной частью выхлопной системы, установленной практически на всех современных транспортных средствах. Его основная задача — уменьшить количество вредных соединений, которые могут попасть в атмосферу. В первую очередь это: окись углерода (СО), углеводороды (СН) и оксиды азота (NOx).
Как это работает?
Работа реактора основана на химической реакции соединений, содержащихся в выхлопных газах, с катализатором, которые представляют собой редкие металлы (включая иридий и платину), заключенные в металлическую банку.
В бензиновых двигателях так называемые трехходовые катализаторы, известные как TWC (Трехсторонний катализатор). Их название происходит от одновременной реакции с тремя группами вредных соединений: эти катализаторы восстанавливают как оксиды азота, так и окисляют углеводороды и оксид углерода.
Иная ситуация в дизельных двигателях. Как и в бензиновых установках, реакторы окисляют соединения СН и СО, но они не уменьшают вредные оксиды азота одновременно.
Последние уменьшаются за счет рециркуляции выхлопных газов в самом двигателе. Так называемый твердые (сажа) частицы, которые могут быть уменьшены путем перезарядки.
Когда это работает?
Катализатор не работает сразу после запуска двигателя: минимальная температура, при которой он начинает уменьшать количество вредных веществ в выхлопных газах, составляет около 300 градусов по Цельсию (катализаторы размещаются как можно ближе к выпускному коллектору для быстрого нагрева).
В свою очередь, фактическая рабочая температура составляет около 800 градусов Цельсия. В последних моделях автомобилей используются два катализатора: первый работает в так называемых холодный старт, второй при нормальной работе двигателя.
Что ломается?
Средний катализатор сохраняет свои свойства до 100 000 километров пробега (в некоторых случаях долговечность каталитического вклада может быть намного выше). Небрежность в результате отсутствия технических проверок и механических повреждений способствуют значительному сокращению срока его службы.
В первом случае это o масло или охлаждающая жидкость, попавшие в выпускную систему, в другом — быстрое охлаждение катализатора (например, после вождения в глубокую лужу на проезжей части) или его повреждение, например, в результате внезапного столкновения с высокой бордюром.
В дизельных двигателях проблема с катализатором также может быть связана с отсутствием его проходимости.
Почему? Установки, работающие на дизельном топливе, выделяют большее количество твердых частиц, что увеличивает вероятность засорения конвертера. Для оценки проходимости катализатора, измерение так называемого противодавление выхлопных газов при работающем двигателе на холостых оборотах.
Катализатор и LPG
В правильно функционирующей газовой установке смесь пропан-бутан не оказывает неправильного воздействия на каталитическую систему. Проблема может заключаться в установках СНГ самого старого поколения без электронного регулирования состава газовоздушной смеси.
В этих установках используется смеситель (так называемое сопло Вентури), и состав выхлопных газов зависит от его регулирующих свойств, что во многих случаях неуместно. Как следствие, это приводит к быстрому снижению каталитических свойств и повреждению самого реактора.
что это, зачем он нужен, устройство, принцип работы, виды
Выхлопная система современного авто, произведенного за рубежом или собранного по лицензии в России, намного сложнее того, что отечественный автопром устанавливал еще пару десятилетий назад на «Лады» собственного производства.
Выбросы автомобилей в атмосферу
Незаменимые в быту и хозяйственной деятельности человека автомобили представляют наибольшую опасность для среды обитания человека. Вредное воздействие продуктов сгорания автомобильных двигателей имеет глобальные и локальные последствия:
- Глобальные. Толщина и площадь озонового слоя, защищающего Землю от космических излучений, за последние десятилетия катастрофически уменьшилась, что в перспективе создает опасность для существования человечества.
- Локальные. В мире есть еще немало территорий с чистой экологией. Но это никак не касается городов, где уже сегодня дышать чистым воздухом практически невозможно.

Как в этих процессах участвуют наши автомобили? Самым непосредственным образом! Их доля в загрязнении окружающей среды составляет не менее 70%. Всего за один год эксплуатации среднестатистический автомобиль выбрасывает в атмосферу:
- 135 кг окиси углерода;
- 25 кг оксидов азота;
- 20 кг углеводородов;
- 4 кг двуокиси серы;
- 1,2 кг твердых частиц;
- до 10 кг бензопропилена.
Всего получается не менее 12 миллионов тонн веществ, которые уничтожают не только среду обитания человека, но и разрушают защитный озоновый слой планеты. С каждым годом количество автомобилей увеличивается, что в перспективе не сулит ничего хорошего.
В связи с этим на международном уровне приняты стандарты качества топлива и количества вредных веществ, попадающих в атмосферу в процессе его сгорания в автомобильном двигателе. С 2005 года в странах Евросоюза установлен экологический стандарт Евро-5 для всех производимых транспортных средств.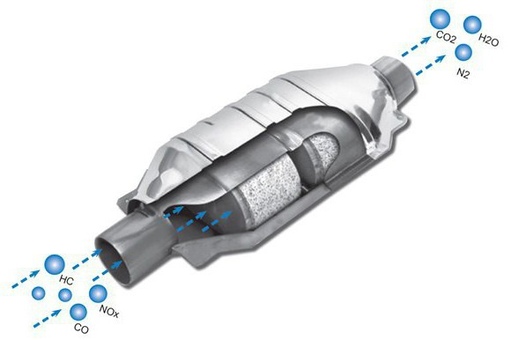 В России переход на стандарт Евро-4 осуществлен в 2015 году.
В России переход на стандарт Евро-4 осуществлен в 2015 году.
Зачем нужен катализатор
Каталитический нейтрализатор выхлопных газов – элемент выхлопной системы автомобиля, ответственный за нейтрализацию вредных для экологии продуктов сгорания бензина – углеводородов, окисей азота и углерода, сажи. В любой каталитический реакции обязательно присутствую активные реагенты. В автомобильном катализаторе нейтрализация вредных веществ осуществляется в мелкоячеистых порах, покрытых тонким слоем редкоземельных и благородных металлов – палладий, иридий, платина. Благодаря им несгоревшие вещества принудительно и практически бесследно дожигаются.
Принцип работы
Трехкомпонентный каталитический нейтрализатор действует следующим образом:
- исходящие из цилиндров двигателя внутреннего сгорания выхлопные газы заполняют покрытые платиной и палладием ячейки, размещенные в керамических блоках;
- металлическое покрытие ячеек инициирует химическую реакцию, в результате которой происходит преобразование несгоревших углеводородов в водяной пар, а угарный газ превращается в углекислый;
- проходя через покрытые родием ячейки, оксид азота распадается на нейтральный азот и кислород;
- результат – из выхлопной трубы наружу поступают полностью очищенные от вредных компонентов газы.

Если в автомобиле установлен дизельный двигатель, то совместно с катализатором работает сажевый фильтр.
Устройство
Нейтрализатор всегда расположен после выпускного коллектора двигателя. В его состав входит:
- изготовленный из металла корпус с патрубками на входе и выходе;
- монолитный керамический блок, представляющий собой пористую структуру с многочисленными ячейками, обеспечивающими максимально большую площадь рабочей поверхности, с которой соприкасаются отработанные газы;
- каталитический слой, состоящий из редкоземельного палладия, иридия и благородной платины, а в некоторых моделях и менее дорогостоящего золота;
- теплоизоляционный металлический кожух, защищающий устройство от механических повреждений.
Катализатор предназначен для нейтрализации трех вредоносных компонентов выхлопных газов:
- ядовитых окислов азота, которые участвуют в образовании смога, провоцируют кислотные дожди;
- угарного газа, смертельно опасного для человеческого организма;
- канцерогенных углеводородов.

Виды
В современных автомобилях производители устанавливают катализаторы различных типов и модификаций. Вне зависимости от устройства и используемых для нейтрализации вредных продуктов сгорания топлива, все они более или менее в равной степени обеспечивают соответствующую европейским нормам степень очистки.
В современных автомобилях используются катализаторы:
- химические;
- металлические;
- керамические;
- магнитно-стрикционные.
Металлические
Это дорогостоящие катализаторы, в процессе производства требуют сложного технологического оборудования. В результате устройство не подвержено механическим воздействиям, колебаниям температуры. Металлическая передняя часть блока может служить нагревательным элементом. Тонкие стенки несущего материала обеспечивают невысокое аэродинамическое сопротивление, что позволяет использовать катализатор во всех разновидностях техники, в том числе повышенной мощности. Среди преимуществ – пониженный расход топлива и длительный срок эксплуатации.
Среди преимуществ – пониженный расход топлива и длительный срок эксплуатации.
Керамические катализаторы
Наиболее популярная сотовая конструкция, которая устанавливается на большинстве современных моделей автомобилей. Керамическая поверхность покрывается перечисленными выше благородными и редкоземельными металлами, которые активизируют свои каталитическое свойства под воздействием тепла. Срок службы керамического устройства в Европе не превышает 120 000 км. Это обстоятельство несколько смущает покупателей подержанных автомобилей. Но ввиду низкого качества бензина отечественного производства замену катализатора придется апроизвести после пробега максимум 80 000 км. Керамика – материал хрупкий и поэтому тряска наших дорог на ее целостности отражается самым негативным образом.
Сажевый фильтр
Если в бензиновом автомобиле используется каталитический нейтрализатор, то для очистки выхлопа дизеля устанавливается сажевый фильтр. Его задача – улавливание частиц сажи. Сажевый фильтр не имеет целью нейтрализацию вредных отходов в отработанных газах. В некоторых моделях авто производители устанавливают в сажевый фильтр дополнительные ячейки, предназначенный для улавливания содержащихся в газах вредных веществ.
Сажевый фильтр не имеет целью нейтрализацию вредных отходов в отработанных газах. В некоторых моделях авто производители устанавливают в сажевый фильтр дополнительные ячейки, предназначенный для улавливания содержащихся в газах вредных веществ.
Спортивный
Повышенная эффективность спортивного катализатора достигается за счет увеличенного слоя катализаторов. Напыления драгметаллов превосходит стандартные нейтрализаторы в 3-8 раз. В результате увеличивается его пропускная способность и срок эксплуатации. Спортивное устройство предназначено вовсе не для любителей экстремальной езды. Его можно установить и на дорогой спорткар, и на простой б/у автомобиль среднего класса.
Двухсторонние
Такие катализаторы предназначены для:
- преобразования вредного для здоровья угарного газа в нейтральный углекислый газ;
- окисления не полностью сгоревших углеводородов в воду и обычный углекислый газ.
Такие устройства нашли применение в дизельных двигателях.
Трехсторонние
Этот тип нейтрализатора решает следующие задачи:
- разложение окиси азота на составляющие – чистый азот и кислород;
- окисление угарного газа до углекислого газа;
- преобразование несгоревших продуктов в углекислый газ и воду.
Что делать, если катализатор вышел из строя
Катализатор ремонту не подлежит. Любая попытка обмануть бортовой компьютер приведет к тому, что ваш автомобиль превысит допустимые в цивилизованных странах пределы содержания вредных веществ в выхлопных газах. Цивилизованное решение – сдать вышедшую из строя деталь в утиль и установить новую, обеспечивающую безопасность для окружающих.
Принцип работы и устройство автомобильного катализатора
Требования к экологической чистоте транспорта становятся все жестче, поэтому инженеры автопроизводителей работают над улучшением устройств, отвечающих за очистку выхлопных газов. Одним из них стал катализатор, устройство и принцип работы которого будет рассматриваться далее. Это ответ на все рассуждения по поводу того, что можно оптимизировать качество моторного масла, топлива, рассчитывать оптимальную смесь, при которой происходит лучшее сгорание, но для этих улучшений в какой-то момент приходит предел.
Одним из них стал катализатор, устройство и принцип работы которого будет рассматриваться далее. Это ответ на все рассуждения по поводу того, что можно оптимизировать качество моторного масла, топлива, рассчитывать оптимальную смесь, при которой происходит лучшее сгорание, но для этих улучшений в какой-то момент приходит предел.
Устройство катализатора
Особенности конструкции
Принцип работы
Классификация
Срок службы катализатора
Удалить катализатор: можно или нет
Самостоятельная диагностика работы катализатора
Ужесточение требований к составу выхлопных газов, образующихся при полноценной работе двигателя внутреннего сгорания, приводит к необходимости использовать более прогрессивные решения для очистки. В состав современной выхлопной системы обязательно входят элементы системы дополнительной очистки: сажевый фильтр, нейтрализатор, система дожига топлива. Их задача состоит в минимизации вредных соединений, которые выбрасываются ТС в атмосферу во время движения.
Устройство катализатора
Катализатор представляет собой компонент, необходимый для нейтрализации вредных соединений, являющихся составными частями выхлопов. При сгорании топлива формируются углеводороды, окрашивающие выходящие газы в темный цвет, оксидов азота и углерода. Эти соединения и вызывают у экологов негативные реакции.
Работа нейтрализатора, изначально присутствующего в выхлопной системе, направлена на окислительно-восстановительные химические реакции, приводящие к образованию безвредных веществ: воды, углекислого газа и азота. Это треступенчатые нейтрализаторы, которые и используются в большинстве автомобилей последних моделей. Принцип работы автомобильного катализатора обеспечивает превращение опасных для экологии газов в безопасные соединения, выходящие в атмосферу.
Работа нейтрализатора не требует каких-то вспомогательных источников энергии, так как активное покрытие обеспечивает протекание любых реакций. Рабочая температура элемента достаточно высокая, поэтому он находится за выпускным коллектором, но не слишком близко к мотору, чтобы не перегреваться. Такое расположение обеспечивает выход на рабочий режим за счет разогрева раскаленными выхлопными газами.
Принцип работы катализатора обеспечивает его полноценное функционирование после полного прогревания. Контролировать его работу должны лямбда-зонды – датчики кислорода, установленные перед входом в катализатор и после выхода из него. Для электронного блока управления важной является информация по количеству остаточного кислорода в выхлопе, по которому делаются выводы о функционировании мотора. Если требуется коррекция, то ЭБУ передает сигнал на увеличение или уменьшение воздушной и топливной подачи в систему камер сгорания.
Особенности конструкции
Если принцип работы катализатора выхлопных газов понятен, то можно сказать несколько слов об его устройстве. Нейтрализатор состоит из нескольких ключевых компонентов:
- Сразу за выпускным коллектором размещен цельный стальной корпус, внутри которого есть термоизолирующий слой, защищающий основной компонент.
- Нейтрализатор имеет наполнитель в виде сотовой структуры, покрытой внутри активным слоем. В зависимости от производителя устройства в качестве каталитического вещества может использоваться родий, платина, палладий, платиново-иридиевый сплав. Сотовая структура обеспечивает повышение площади контакта газов с активным вещество, поэтому химические реакции проходят более интенсивно.
- Наполнитель изготовлен из металла или керамики. Выбор материала зависит от конструкции и конечной стоимости оборудования.
Принцип работы
Принцип работы катализатора в автомобиле достаточно прост и базируется на определенной последовательности химических реакций:
- Внутренняя поверхность сот покрыта драгоценными металлами, которые отвечают за активацию процессов окисления.
- Оксид азота в результате реакции разлагается на атомы азота и кислорода. Азот объединяется в молекулы, образуя устойчивый азот. Кислород соединяется с угарным газом до образования углекислого газа.
- Катализатор захватывает из выхлопных газов остаточный кислород, расщепляет углеводороды, давая на выходе такие соединения, как углекислый газ и вода.
- Остаточный кислород на выходе из катализатора фиксируется лямбда-зондом, чтобы передать сведения о работе устройства штатному бортовому компьютеру.
Исправное устройство в оптимальных условиях не накапливает ничего внутри себя: все вещества, которые поступают в нейтрализатор, покидают его сотовую структуру. Но добиться этого практически невозможно, поэтому со временем происходит деградация каталитического нейтрализатора, что не дает ему полноценно справляться с задачей.
Классификация
Катализаторы можно разделить на категории по функциональности: на двух- и трехкомпонентные. Первый тип работает только с обезвреживанием угарного газа с углеводородами. Такие модели считаются устаревшими, поэтому не устанавливаются на автомобилях новых версий. Трехкомпонентные обеспечивают нейтрализацию оксида азота. Этот вид теперь устанавливается на всех современных автомобилях.
Если говорить о материале изготовления, то принято выделять керамические, металлические и спортивные:
- Керамические считаются самыми дешевыми, но это и наиболее хрупкие катализаторы. При ударе по корпусу происходит разрушение сердцевины. Устройства страдают от перепадов температур, сбоев в системе зажигания авто. Катализатор может постепенно разрушаться, что приводит к образованию большого количества мелкой пыли, которая проникает сквозь выпускной коллектор в мотор, что приводит к поломкам. В результате всех этих неполадок может потребоваться капитальный ремонт.
- Металлические – это дорогие, но надежные устройства, изготовленные из металлической структуры в виде сот. Она отличается упругостью и устойчивостью к механическим и температурным воздействиям. Металл не способен образовывать мелкие частицы, поэтому для двигателя он не представляет опасности.
- Спортивные отличаются повышенной пропускной способностью, поэтому мотор становится мощнее на несколько процентов. Спортивные монтируются в прямоточные системы выхлопных газов. Их считают наиболее надежными, хоть они и самые дорогостоящие.
Срок службы катализатора
Для катализатора средний ресурс составляет 100 тысяч километров пробега, но в условиях правильной эксплуатации он способен исправно отработать до 200 тысяч. Ранний износ может произойти из-за низкого качества топлива (топливно-воздушной смеси) и проблем с мотором.
Если топливная смесь обедненная, то случается перегрев нейтрализатора, если слишком богатая, то это приводит к засорению пористого блока остатками несгоревшего топлива, из-за чего не протекают необходимые химические реакции. Это вызывает проблемы в работе катализатора с его ускоренным выходом из строя.
Механические повреждения тоже часто приводят к возникновению неисправностей. Удары и различные механические воздействия приводят к возникновению трещин. Это становится причиной стремительного разрушения блоков.
Если возникает любая неисправность, каталитический нейтрализатор начинает хуже работать, что можно понять по показаниям, поступающим в ЭБУ от лямбда-зонда, установленного на выходе из нейтрализатора. Сообщение о неисправности может высвечиваться на приборной панели в виде ошибки «Check Engine». Помимо этого, о выходе из строя свидетельствует ухудшение динамики, увеличение топливного расхода и дребезжание при движении.
В такой ситуации требуется его замена на новый. При этом можно установить новый оригинальный компонент либо воспользоваться универсальным. Восстановление или чистка не возможны, а так как новый компонент обычно стоит довольно дорого, многие автовладельцы предпочитают удалить его.
Удалить катализатор: можно или нет
Так как повлиять на принцип работы датчика катализатора невозможно, и он будет выдавать ошибку, если компонент вышел из строя, то многие автовладельцы предпочитают использовать альтернативные довольно радикальные подходы. Чаще всего просто удаляют катализатор, а на его место устанавливают пламегаситель, который выравнивает поток выхлопных газов. Его рекомендуется использовать для устранения неприятных шумов, сопровождающих движение транспорта, у которого отсутствует катализатор.
Если было решено удалить катализатор, то рекомендуется его полностью снять, а не прибегать к рекомендации автомобилистов просто пробить отверстие в нем. Такая процедура способна слегка улучшить ситуацию на некоторое время.
В машине, которая соответствует экологическому стандарту Евро-3, требуется не только удалить катализатор, но и выполнить перепрошивку ЭБУ. Обновление выполняется до версии, в которой каталитический нейтрализатор отсутствует.
Дополнительно можно установить эмулятор сигнала от кислородного датчика, чтобы не потребовалось перепрошивать ЭБУ полностью.
Самое лучшее решение при поломке каталитического нейтрализатора – это его замена на оригинальный компонент в рамках специализированного сервиса, где работают профессиональные мастера с достаточным опытом. Это обеспечивает исключение вмешательства в конструкцию автомобиля, поэтому сохранится соответствие его экологического класса стандарту, прописанному производителем.
Самостоятельная диагностика работы катализатора
Если машина стала ездить хуже, а на приборной панели загорелся «чек», то можно отправиться в сервисный центр, где после тщательной диагностики станет понятно, что произошло. Однако можно самостоятельно выполнить элементарную диагностику функционирования катализатора:
- Оценить оттенок выхлопа: если он черный, то это явный признак того, что нейтрализатор не работает, поэтому через него и проходят все вредные вещества и газу наружу.
- Оценить давление газов, выходящих наружу: если приложить ладонь к отверстию выхлопной трубы, то напор должен быть высоким. Если он низкий, то это свидетельствует о необходимости замены катализатора.
- После длительной поездки заглянуть под машину: если корпус катализатора раскален, то можно говорить о снижении его пропускной способности.
- В сервисе можно проверить давление выхлопа и сравнить его с показателями эталонных данных. Для определения давления манометр размещается там, где обычно установлен лямбда-зонд.
- Визуально можно оценить демонтированный нейтрализатор выхлопа на предмет оплавления, засорения или выгорания.
Заменить катализатор требуется после того, как точно установлено, что проблемы в работе автомобиля возникли из-за оплавленных или забитых сот. Но рекомендуется отыскать причину, по которой случилось засорение нейтрализатора, так как после установке нового элемента он тоже может пострадать от тех же неполадок. Поэтому в современных авто все системы связаны очень сильно, для чего используется большое количество датчиков.
что это такое, признаки поломки, состав и принцип работы
Европейские нормы экологии заставляют принимать меры к тому, чтобы выхлопные газы автомобилей не наносили сильного ущерба окружающей среде.
И эта борьба за природу привела к тому, что автомобили стали оборудоваться специальными устройствами, которые назвали катализаторами.
Состав и принцип работы катализатора выхлопных газов
Из школьных уроков мы помним, что катализ – это что-то из области химической реакции, и поэтому термин «катализатор» подразумевает под собой какой-то прибор, необходимый для такого действия.
Мы не химики и оценить точность определения вряд ли сможем, но то, что автомобильный катализатор предназначен для очистки выхлопной смеси — факт, о котором сообщает сам производитель. А ему не принято не верить.
Несмотря на то, что европейские нормы выхлопов введены в России не так давно, первые катализаторы в автомобилях отпраздновали уже 40-летний юбилей. Упрощение до нынешнего названия произошло гораздо позже, а первое время именовалась эта штука конвертером, или каталитическим преобразователем. Сами понимаете, что не каждый работник автосервиса сможет сходу и без запинки выговорить такое.
Катализатор встраивается в выхлопную систему автомобиля, причём конкретное место установки выбирает сам производитель. Так, он может находиться и в коллекторе, и в основании выхлопной трубы, и в других её участках.
Есть два вида катализаторов: окислительный и восстанавливающий. Независимо от разделения, эти устройства, наверное, одни из самых дорогостоящих. Судите сами: основу их составляет структура из керамики, напоминающая пчелиные соты, покрытые металлами, которые простыми не назовёшь – платина, золото, палладий и иридий. Даже удивительно, куда смотрят жулики, оставляющие выхлопную систему автомашин, припаркованных во дворах, в покое?
Как бы то ни было, но подобное покрытие ячеек катализатора необходимо вовсе не для того, чтобы вытянуть деньги с автолюбителя. Дело в том, что драгоценные металлы эффективней очищают выхлопные газы, одновременно предоставляя большую площадь для очистки с минимальным ущербом для самого катализатора. Если исключить драгоценные металлы из сплава, то само устройство будет настолько недолговечным и подверженным негативному воздействию выхлопных газов, что менять его придётся несколько раз в течение одной небольшой поездки.
Опытным путем было установлено, что один катализатор вряд ли сможет работать эффективно, а потому на современных автомобилях их устанавливают в трех экземплярах. Они не дублируют друг друга, а делают узконаправленную работу, выполняя очистку от тех веществ, для которых предназначены.
Видео — что это такое автомобильный катализатор и как он работает:
Таким образом, выхлопные газы проходят вначале через восстановительный катализатор, внутри которого на молекулярном уровне идет расщепление поступающего вещества на кислород и азот. Этот процесс как раз и выполняют иридий и платина.
Когда работа проделана, в дело вступают окислительные катализаторы, производящие очистку поступивших веществ. Здесь уже совместно с платиной вступает в действие палладий, снижая количество окиси углерода и облегчая реакцию углекислого газа с кислородом.
Маленькие вспомогательные «хитрости»
Как бы ни эффективно очищался выхлоп двигателя, но в ручном режиме регулировать точность выброса в атмосферу было б не просто затруднительно, а в принципе невозможно. Тем более толку от такой системы было б совсем немного: только в рамках информации для общего развития. Дело в том, что вместе с катализаторами выхлопная система оснащена датчиками, входящими в систему управления автомобилем.
Имея связь с компьютером, эти устройства учитывают количество кислорода, поступающего вместе с выхлопом мотора. В том случае, если через катализатор будет проходить воздуха столько, что он не сможет его переработать, забор через воздушный фильтр двигателя уменьшается. Датчики устанавливаются ближе к мотору и замеряют газы непосредственно на выходе.
Недостатки тоже есть
Наличие драгоценных металлов в конструкции катализатора еще не означает того, что оно решает все проблемы. Необходимо еще соблюсти ряд условий для работы.
Опять же, благодаря курсу средней школы, мы все знаем, что любая химическая реакция (а именно на этом принципе основан катализатор) происходит тем быстрее, чем выше температура. Отсюда сами понимаете, что устройство не сможет эффективно функционировать, если температурный режим ниже необходимого. То есть налицо вывод о том, что в момент начала работы автомобильного двигателя катализатор фактически никак не реагирует на количество вредных веществ, выброшенных в атмосферу до тех пор, пока они же не нагреют трубопровод системы.
Видео — как извлечь каталитический нейтрализатор:
Самый простой способ такого нагрева – помещение устройства непосредственно к основанию газоотводной трубы возле стенки двигателя. Но при включении холодного двигателя при такой установке катализатор все равно первое время работать не будет, пока не согреется. Современный и эффективный способ, который заставит его действовать с самого начала – предпусковой подогреватель двигателя, расходующий часть энергии на утепление.
Несмотря на то, что в выхлопной системе дизельных двигателей тоже есть подобные каталитические преобразователи, действуют они не столь впечатляюще. Дело тут также в недостаточной температуре нагрева. Дизели не так зависимы от окружающей среды и имеют возможность работать в зоне таких низких температур, что катализаторы просто не успевают достичь нагрева до степени осуществления химической реакции.
Признаки забитого катализатора
Но эти недостатки – мелочь по сравнению с ситуацией, когда вы садитесь за руль, а машина либо не заводится, либо глохнет, едва только двигатель сделает один-другой поворот коленвала. Понятное дело: мысли в поисках причин такого поведения начинают роиться в голове, и только потом, когда проверено всё и вся, становится понятным, что неполадки как раз с катализатором.
Чтобы проверить правоту своих домыслов, выкрутите датчик, расположенный перед первым катализатором, и попробуйте запустить мотор. Если никаких проблем в работе двигателя нет, то причина как раз в устройстве, о котором мы здесь говорим. Теперь необходимо полным ходом отправляться в автосервис и менять катализатор. Самостоятельно сделать это вряд ли получится, так как необходимо вносить корректировки в бортовой компьютер, чтобы настроить датчик на правильную работу.
Видео — как проверить катализатор на машине:
Если вы знаете свой автомобиль как пять пальцев, то наверняка вас насторожат и такие признаки неисправности каталитического нейтрализатора, как плохой разгон, педаль акселератора, слабо реагирующая на нажатие, рост расхода топлива. Подобное поведение машины говорит о том, что катализатор скоро выработает свой срок.
Проверка катализатора манометром
Как только вы заметили явные изменения в поведении своего авто, примите меры к проверке каталитического нейтрализатора. Признаки, о которых говорилось выше, не всегда могут относиться к тем, что сигнализируют о неисправности именно этого устройства.
Осмотрите катализатор. Если на корпусе имеются сильные вмятины, либо разводы, похожие на круги от воздействия высокой температуры, наверняка причины неполадок кроются внутри. По возможности осмотрите внутренние соты. Если они разрушены, первый «звоночек» уже прозвенел.
Точнее можно проверить с помощью замера манометром. Правда, это не тот прибор, которым проверяют давление в шинах, поэтому лучше также доверить эту операцию специалистам. Сам алгоритм действия следующий: вместо первого кислородного датчика, используя переходник, устанавливается измерительный прибор. После заводится двигатель, обороты поднимаются до 3000 об/мин. Если стрелка на шкале преодолела отметку в 0,3 кгс/см2, то катализатор забит, и наступило время для его замены.
И самое главное – придирчиво относитесь к тому, чтобы топливо и масло всегда были надлежащего качества, иначе весь осадок от них будет накапливаться в катализаторе, что также будет способствовать его скорому выходу из строя.
Как выполняется полировка фар своими руками в домашних условиях узнаете из статьи.
В каких случаях может помочь сумка-холодильник для автомобиля.
Как выбрать автомобильный компрессор https://voditeliauto.ru/poleznaya-informaciya/aksessuary-i-gadzhety-dlya-avto/avtomobilnyj-kompressor.html для подкачки шин.
Видео — проблемы катализаторов на автомобилях ВАЗ:
Каталитические нейтрализаторы — Что такое Каталитические нейтрализаторы?
Каталитический нейтрализатор (обиходное название – катализатор) предназначен для снижения токсичности отработавших газов
Нейтрализатор — устройство в выхлопной системе, предназначенное для снижения токсичности отработавших газов посредством восстановления оксидов азота и использования полученного кислорода для дожига угарного газа и недогоревших углеводородов.
Основным требованием к успешной работе катализатора является стехиометрическое соотношение топлива и кислорода.
Задачей автомобильного каталитического нейтрализатора является снижение количества вредных веществ в выхлопных газах.
Среди них:
-
окись углерода (СО) — ядовитый газ без цвета и запаха;
-
углеводороды (CH), также известные как летучие органические соединения — один из главных компонентов смога, образуется за счет неполного сгорания топлива;
-
оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) - также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
Принцип работы
Каталитический нейтрализатор расположен либо на приемной трубе, либо сразу после нее.
Внутри корпуса каталитического нейтрализатора находится керамическая сотовая конструкция.
Соты нужны, чтобы увеличить площадь контакта выхлопных газов с поверхностью, на которую нанесен тонкий слой платиноиридиевого сплава.
Недогоревшие остатки (CO, CH, NO) касаясь поверхности каталитического слоя, окисляются до конца кислородом, присутствующим также в выхлопных газах.
В результате реакции выделяется тепло, разогревающее катализатор и, тем самым, активизируется реакция окисления.
В конечном итоге на выходе из катализатора (исправного) выхлопные газы содержат в основном N2 и СО2.
Катализаторы в дизельных двигателях
Каталитические преобразователи дизельных двигателей плохо справляются с сокращением выбросов NOx.
Одна из причин в том, что дизельные двигатели сами по себе функционируют в более низком температурном режиме, чем бензиновые, а преобразователи работают лучше при нагреве.
Некоторые ведущие эксперты в области «зеленого» автомобилестроения придумали новую выхлопную систему, которая помогает исправить этот недостаток.
Они впрыскивают водный раствор мочевины в выхлопную трубу до того, как газы достигнут преобразователя.
При этом возникает химическая реакция, которая уменьшает количество NOx.
Карбамид, также известный как мочевина — органическое соединение углерода, азота, кислорода и водорода.
Его можно обнаружить в моче млекопитающих и земноводных, что и объясняет такое название.
Мочевина реагирует с NOx с получением азота и водяного пара, снижая количество оксидов азота в выхлопных газах более чем на 90%.
Определение катализаторови принцип их работы
Катализатор — это химическое вещество, которое влияет на скорость химической реакции, изменяя энергию активации, необходимую для протекания реакции. Этот процесс называется катализом. Катализатор не расходуется в реакции и может одновременно участвовать в нескольких реакциях. Единственное различие между каталитической реакцией и некаталитической реакцией состоит в том, что энергия активации различается. Не влияет на энергию реагентов или продуктов.ΔH для реакций одинакова.
Как работают катализаторы
Катализаторы допускают альтернативный механизм превращения реагентов в продукты с более низкой энергией активации и другим переходным состоянием. Катализатор может позволить реакции протекать при более низкой температуре или увеличить скорость или селективность реакции. Катализаторы часто реагируют с реагентами с образованием промежуточных продуктов, которые в конечном итоге дают те же продукты реакции и регенерируют катализатор. Обратите внимание, что катализатор может быть израсходован на одном из промежуточных этапов, но он будет создан снова до завершения реакции.
Положительные и отрицательные катализаторы (ингибиторы)
Обычно, когда кто-то ссылается на катализатор, они имеют в виду положительный катализатор , который является катализатором, который ускоряет скорость химической реакции за счет снижения его энергии активации. Существуют также отрицательные катализаторы или ингибиторы, которые замедляют скорость химической реакции или уменьшают ее вероятность.
Промоторы и каталитические яды
Промотор — это вещество, повышающее активность катализатора.Каталитический яд — это вещество, инактивирующее катализатор.
Катализаторы в действии
- Ферменты — это биологические катализаторы, специфичные для реакции. Они реагируют с субстратом с образованием нестабильного промежуточного соединения. Например, карбоангидраза катализирует реакцию:
H 2 CO 3 (водн.) ⇆ H 2 O (l) + CO 2 (водн.)
Фермент позволяет реакции быстрее достичь равновесия. В случае этой реакции фермент позволяет диоксиду углерода диффундировать из крови в легкие, чтобы его можно было выдохнуть. - Перманганат калия является катализатором разложения перекиси водорода на газообразный кислород и воду. Добавление перманганата калия увеличивает температуру реакции и ее скорость.
- Некоторые переходные металлы могут действовать как катализаторы. Хороший пример использования платины в автомобильном катализаторе. Катализатор позволяет превратить токсичный оксид углерода в менее токсичный диоксид углерода. Это пример гетерогенного катализа.
- Классическим примером реакции, которая не протекает с заметной скоростью, пока не добавлен катализатор, является реакция между газообразным водородом и газообразным кислородом.Если смешать два газа вместе, ничего особенного не произойдет. Однако, если вы добавите тепло от зажженной спички или искры, вы преодолеете энергию активации, чтобы начать реакцию. В этой реакции два газа реагируют с образованием воды (взрывоопасно).
H 2 + O 2 ↔ H 2 O - Реакция горения аналогична. Например, когда вы зажигаете свечу, вы преодолеваете энергию активации, применяя тепло. Как только реакция начинается, тепло, выделяющееся в результате реакции, преодолевает энергию активации, необходимую для ее протекания.
Как работают катализаторы?
Как работают катализаторы?Чтобы подвести итог, см. «Разработка топлива»
- В химической реакции связи, удерживающие реагенты вместе, должны быть сначала разорваны, прежде чем реакция может начаться.
- Для разрыва связей требуется энергия, и энергия, необходимая для начала реакции, называется энергией активации
- Катализаторы работают, обеспечивая альтернативный путь реакции для разрыва и восстановления связей.Энергия активации этого нового пути часто меньше, чем энергия активации нормального пути.
- Итак, как работают катализаторы? Что ж, это действительно очень просто! Когда присутствует гомогенный катализатор, один из реагентов (субстрат) реагирует с катализатором, образуя промежуточный продукт. Промежуточный продукт затем вступает в реакцию с другим реагентом с образованием конечного продукта.
- Энергия активации обеих этих стадий ниже, чем энергия активации без присутствия катализатора, поэтому большее количество молекул будет иметь энергию для реакции с использованием катализатора; следовательно скорость реакции увеличивается.
- Возьмем, к примеру, реакцию между озоном и свободными радикалами кислорода с образованием ди-кислорода.
O 3 (г) + O (г) 2O 2 (г) - Эта реакция имеет высокую энергию активации, поэтому процесс протекает с медленной скоростью.
- Однако присутствие CFC в атмосфере катализирует эту реакцию с образованием промежуточных продуктов.
Класс . г + O 3 (г) O 2 (г) + ClO . (г) - Эта реакция имеет более низкую энергию активации, чем реакция между свободными радикалами озона и кислорода. Промежуточный продукт (ClO) затем вступает в реакцию со свободным кислородным радикалом.
ClO (г) + O (г) Cl . (г) + O 2 (г) - Реагенты и продукты остаются теми же; однако хлор использовался в качестве катализатора для образования промежуточного продукта (требующего меньшей энергии активации).
- Это значительно увеличивает скорость, а хлор остается неизменным и может продолжать катализировать другую реакцию.
Полезные книги для доработки:
Revise AS Chemistry for Salters (Написано опытными экзаменаторами и учителями химии Salter)Revise AS Chemistry for Salters (OCR) (Продвинутая химия Salters) Главная
7.4 Механизм реакции и катализа | Скорость и степень реакции
Ранее упоминалось, что именно столкновение частиц вызывает реакцию, и что только некоторые из этих столкновений являются успешными.Это связано с тем, что частицы реагента имеют широкий диапазон кинетических энергий, и только небольшая часть частиц будет иметь достаточно энергии (и правильную ориентацию), чтобы фактически разорвать связи, чтобы могла произойти химическая реакция. Минимальная энергия, необходимая для протекания реакции, называется энергией активации . Для получения дополнительной информации об энергии реакций обратитесь к 11 классу (глава 12).
Энергия активации (ESCN9)
- Энергия активации
Минимальная энергия, необходимая для протекания химической реакции.
Даже при фиксированной температуре энергия частиц меняется, а это означает, что только некоторые из них будут иметь достаточно энергии, чтобы участвовать в химической реакции, в зависимости от энергии активации этой реакции (рис. 7.9). Повышение температуры реакции приводит к увеличению количества частиц, обладающих достаточной энергией, чтобы участвовать в реакции, и к увеличению скорости реакции.
Рисунок 7.9: Распределение кинетической энергии частиц при фиксированной температуре.
Помните, что для реакции молекула должна иметь энергию, превышающую энергию активации, а также правильную ориентацию.
Повышение температуры реакционной смеси увеличивает среднюю кинетическую энергию частиц. Как видно на графике (рис. 7.10), большая часть частиц теперь может реагировать, ускоряя реакцию. С увеличением движения молекул также увеличиваются шансы молекулы иметь правильную ориентацию.
Рисунок 7.10: Распределение кинетической энергии частиц при повышении температуры. Увеличивается количество частиц с достаточной энергией из-за более высокой температуры.
Эндотермическая реакция может быть представлена как:
\ (\ text {Reactants} + \ color {red} {\ text {Energy}} \ to \ text {Products} \) то есть реакция, которая поглощает энергию
Это может быть показано на диаграмме энергии активации (рисунок 7.11). Эти графики также иногда называют профилем реакции или графиком потенциальной энергии.
Рисунок 7.11: Диаграмма энергии активации с энергией реагента ниже, чем энергия продукта, т. Е. эндотермический
Экзотермическая реакция может быть представлена как:
\ (\ text {Reactants} \ to \ text {Products} + \ color {red} {\ text {Energy}} \) то есть реакция, при которой выделяется энергия
Это может быть показано на диаграмме энергии активации (рисунок 7.12):
Рисунок 7.12: Диаграмма энергии активации с энергией реагента, превышающей энергию продукта, т.е.е. экзотермический
Измените этот раздел с уровня 11 (Энергия активации, Раздел 12.3).
Как работают катализаторы? (ESCNB)
Катализатор увеличивает скорость реакции несколько иначе, чем другие методы увеличения скорости реакции. Функция катализатора состоит в том, чтобы снизить энергию активации, чтобы большая часть частиц имела достаточно энергии для реакции. Катализатор может снизить энергию активации реакции на:
Некоторые металлов e.грамм. платина, медь и железо могут действовать как катализаторы в определенных реакциях. В нашем собственном организме содержится ферментов, — катализаторов, которые помогают ускорить биологические реакции. Катализаторы обычно реагируют с одним или несколькими реагентами с образованием промежуточного химического соединения, которое затем вступает в реакцию с образованием конечного продукта. Промежуточный химический продукт иногда называют активированным комплексом .
Активированный комплекс возникает в реакциях без катализаторов, а также в реакциях с катализаторами.
Ниже приводится пример того, как может протекать реакция с участием катализатора. A и B — реагенты, \ (\ color {blue} {\ text {C}} \) — катализатор, а D — продукт реакции A и B.
Шаг 1: \ ({\ text {A}} + \ color {blue} {\ text {C}} \ to \ text {A} \ color {blue} {\ text {C}} \)
Шаг 2: \ (\ text {B} + \ text {A} \ color {blue} {\ text {C}} \ to \ text {A} \ color {blue} {\ text {C}} \ text {B} \)
Шаг 3: \ (\ text {A} \ color {blue} {\ text {C}} \ text {B} \ to \ color {blue} {\ text {C}} + \ text {D} \)
\ (\ text {A} \ color {blue} {\ text {C}} \ text {B} \) представляет собой промежуточное химическое вещество.Хотя катализатор (\ (\ color {blue} {\ text {C}} \)) расходуется в реакции 1, позже он снова высвобождается в реакции 3, так что общая реакция с катализатором выглядит следующим образом:
\ (\ text {A} + \ text {B} + \ color {blue} {\ text {C}} \ to \ text {D} + \ color {blue} {\ text {C}} \)
Из этого видно, что катализатор высвобождается в конце реакции в совершенно неизменном виде. Без катализатора общая реакция будет:
\ (\ text {A} + \ text {B} \) \ (\ to \) \ (\ text {D} \)
Катализатор обеспечивает альтернативный набор стадий реакции, который мы называем альтернативным путем.Путь с участием катализатора требует меньше энергии активации и, следовательно, быстрее.
Это можно увидеть на следующей диаграмме (Рисунок 7.13).
Рис. 7.13: Доля частиц, обладающих достаточной энергией для реакции, увеличивается в присутствии катализатора.
- Катализатор
Катализатор ускоряет химическую реакцию, но не расходуется на нее. Это увеличивает скорость реакции за счет снижения энергии активации реакции.
Энергетические диаграммы полезны для иллюстрации влияния катализатора на скорости реакции. Катализаторы уменьшают энергию активации, необходимую для протекания реакции (показано меньшим значением энергии активации на энергетической диаграмме на рисунке 7.14), и, следовательно, увеличивают скорость реакции. Помните, что с катализатором средняя кинетическая энергия молекул остается прежней, но требуемая энергия уменьшается (рис. 7.13).
Рисунок 7.14: Влияние катализатора на энергию активации эндотермической реакции. Катализатор будет действовать таким же образом при экзотермической реакции.
Высокие оценки в науке — залог вашего успеха и будущих планов. Проверьте себя и узнайте больше о практике Сиявулы.
Зарегистрируйтесь и проверьте себяСкорость реакции
Учебник Упражнение 7.4Катализатор увеличивает энергию молекул реагента, так что может происходить химическая реакция.
Неверно.Катализатор снижает энергию активации реакции, так что может иметь место химическая реакция.
Повышение температуры реакции приводит к увеличению количества частиц реагента, энергия которых превышает энергию активации.
Катализатор не становится частью конечного продукта химической реакции.
Почему во время реакции происходит уменьшение массы?
Реакция не происходит в закрытом контейнере, поэтому газообразный водород может выйти из реакционного сосуда.{-3} $} \) соляная кислота. Как средняя скорость этой реакции соотносится с исходной скоростью реакции ?
Имеется больший объем соляной кислоты. Однако концентрация не увеличивается, и поэтому скорость реакции не изменяется.
Как катализатор повлияет на среднюю скорость этой реакции?
(IEB Paper 2 2003)
Средняя скорость реакции увеличится.
Напишите вычисленное химическое уравнение этой реакции.
\ (\ text {CaCO} _ {3} (\ text {s}) + 2 \ text {HCl} (\ text {l}) \) \ (\ to \) \ (\ text {CaCl} _ { 2} (\ text {s}) + \ text {CO} _ {2} (\ text {g}) + \ text {H} _ {2} \ text {O} (\ text {l}) \)
используется кусок карбоната кальция такой же массы
Площадь поверхности уменьшена, поэтому средняя скорость реакции снизится. {3} $} \) из \ (\ text {0,2} \) \ (\ text {mol.{-3} $} \) кислота соляная используется
Средняя скорость реакции зависит от концентрации жидких реагентов, а не от объема. Однако концентрация увеличивается, поэтому скорость будет увеличиваться.
12.7 Катализ — химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните функцию катализатора с точки зрения механизмов реакции и диаграмм потенциальной энергии
- Перечислить примеры катализа в природных и промышленных процессах
Мы видели, что скорость многих реакций может быть увеличена с помощью катализаторов.Катализатор ускоряет скорость реакции за счет снижения энергии активации; кроме того, катализатор регенерируется в процессе. Некоторые реакции, которые являются термодинамически благоприятными в отсутствие катализатора, протекают с разумной скоростью только при наличии катализатора. Одной из таких реакций является каталитическое гидрирование, процесс, при котором водород добавляют через связь C = C алкена с получением насыщенного алканового продукта. Сравнение диаграмм координат реакции (также известных как энергетические диаграммы) для катализированного и некаталитического гидрирования алкена показано на рисунке 1.
Рис. 1. На этом графике сравниваются координаты реакции каталитического и некаталитического гидрирования алкена.Катализаторы функционируют, обеспечивая альтернативный механизм реакции, который имеет более низкую энергию активации, чем было бы в отсутствие катализатора. В некоторых случаях каталитический механизм может включать дополнительные этапы, как показано на диаграммах реакций, показанных на рисунке 2. Эта более низкая энергия активации приводит к увеличению скорости, как описано уравнением Аррениуса.Обратите внимание, что катализатор снижает энергию активации как для прямой, так и для обратной реакции и, следовательно, ускоряет как прямую, так и обратную реакции . Следовательно, присутствие катализатора позволит системе быстрее достичь равновесия, но не влияет на положение равновесия, что отражается в значении его константы равновесия (см. Следующую главу о химическом равновесии).
Рис. 2. Эта диаграмма потенциальной энергии показывает влияние катализатора на энергию активации.Катализатор обеспечивает другой путь реакции с более низкой энергией активации. Как показано, каталитический путь включает двухступенчатый механизм (обратите внимание на наличие двух переходных состояний) и промежуточный вид (представленный долиной между двумя переходными состояниями).Пример 1
Использование диаграмм реакций для сравнения каталитических реакций
Две диаграммы здесь представляют одну и ту же реакцию: одна без катализатора, а другая с катализатором. Определите, какая диаграмма предполагает наличие катализатора, и определите энергию активации катализированной реакции:
Раствор
Катализатор не влияет на энергию реагента или продукта, поэтому этими аспектами диаграмм можно пренебречь; они, как и следовало ожидать, идентичны в этом отношении.Однако есть заметная разница в переходном состоянии, которое на диаграмме (b) заметно ниже, чем на (а). Это указывает на использование катализатора на диаграмме (b). Энергия активации — это разница между энергией исходных реагентов и переходного состояния — максимум на координатной диаграмме реакции. Реагенты имеют концентрацию 6 кДж, а переходное состояние — 20 кДж, поэтому энергию активации можно рассчитать следующим образом:
[латекс] E _ {\ text {a}} = 20 \; \ text {kJ} \; — \; 6 \; \ text {kJ} = 14 \; \ text {kJ} [/ latex]
Проверьте свои знания
Определите, какая из двух диаграмм (обе для одной и той же реакции) включает катализатор, и определите энергию активации катализированной реакции:
Ответ:
Диаграмма (b) представляет собой катализируемую реакцию с энергией активации около 70 кДж.
Гомогенный катализатор присутствует в той же фазе, что и реагенты. Он взаимодействует с реагентом с образованием промежуточного вещества, которое затем разлагается или вступает в реакцию с другим реагентом на одной или нескольких стадиях для регенерации исходного катализатора и образования продукта.
В качестве важной иллюстрации гомогенного катализа рассмотрим озоновый слой Земли. Озон в верхних слоях атмосферы, защищающий Землю от ультрафиолетового излучения, образуется, когда молекулы кислорода поглощают ультрафиолетовый свет и вступают в реакцию:
[латекс] 3 \ text {O} _2 (g) \; {\ xrightarrow {hv}} \; 2 \ text {O} _3 (g) [/ latex]
Озон — относительно нестабильная молекула, которая разлагается с образованием двухатомного кислорода по обратному уравнению.Эта реакция разложения соответствует следующему механизму:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} \ text {O} _3 & \ text {O} _2 \; + \; \ text {O} \\ [0.5em ] \ text {O} \; + \; \ text {O} _3 & 2 \ text {O} _2 \ end {array} [/ latex]
Присутствие оксида азота NO влияет на скорость разложения озона. Оксид азота действует как катализатор по следующему механизму:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} \ text {NO} (g) \; + \; \ text {O} _3 (g) & \ text {NO} _2 (g) \; + \; \ text {O} _2 (g) \\ [0.5em] \ text {O} _3 (g) & \ text {O} _2 (g) \; + \; \ text {O} (g) \\ [0.5em] \ text {NO} _2 (g) \ ; + \; \ text {O} (g) & \ text {NO} (g) \; + \; \ text {O} _2 (g) \ end {array} [/ latex]
Общее химическое изменение для каталитического механизма такое же, как:
[латекс] 2 \ text {O} _3 (g) \; {\ longrightarrow} \; 3 \ text {O} _2 (g) [/ latex]
Оксид азота реагирует и регенерируется в этих реакциях. Он не расходуется постоянно; таким образом, он действует как катализатор. Скорость разложения озона выше в присутствии оксида азота из-за каталитической активности NO.Некоторые соединения, содержащие хлор, также катализируют разложение озона.
Марио Х. Молина
Нобелевскую премию по химии 1995 года разделили Пол Дж. Крутцен, Марио Дж. , Молина (рис. 3) и Ф. Шервуд Роуленд «за их работы в области химии атмосферы, особенно в отношении образования и разложения озона». Молина, гражданин Мексики, выполнял большую часть своей работы в Массачусетском технологическом институте (MIT).
Рисунок 3. (a) Мексиканский химик Марио Молина (1943 -) разделил Нобелевскую премию по химии в 1995 году за исследование (b) озоновой дыры в Антарктике. (Фото а: любезно предоставлено Марио Молиной; кредит б: модификация работы НАСА)В 1974 году Молина и Роуленд опубликовали статью в журнале Nature (одна из основных рецензируемых публикаций в области науки) с подробным описанием угроза хлорфторуглеродных газов стабильности озонового слоя в верхних слоях атмосферы Земли. Озоновый слой защищает Землю от солнечного излучения, поглощая ультрафиолетовый свет.По мере того как химические реакции истощают количество озона в верхних слоях атмосферы, над Антарктидой образуется измеримая «дыра», и увеличение количества солнечного ультрафиолетового излучения, тесно связанное с распространением рака кожи, достигает поверхности Земли. Работа Молины и Роуленда сыграла важную роль в принятии Монреальского протокола, международного договора, подписанного в 1987 году, который успешно начал поэтапное прекращение производства химикатов, связанных с разрушением озона.
Молина и Роуленд продемонстрировали, что атомы хлора из химических веществ, созданных человеком, могут катализировать разрушение озона в процессе, аналогичном процессу, при котором NO ускоряет разрушение озона.Атомы хлора образуются, когда хлороуглероды или хлорфторуглероды, которые когда-то широко использовались в качестве хладагентов и пропеллентов, фотохимически разлагаются ультрафиолетом или реагируют с гидроксильными радикалами. Здесь показан пример механизма с использованием хлористого метила:
[латекс] \ text {CH} _3 \ text {Cl} \; + \; \ text {OH} \; {\ longrightarrow} \; \ text {Cl} \; + \; \ text {other \; продукты } [/ латекс]
Хлорные радикалы разрушают озон и регенерируются в следующем каталитическом цикле:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} \ text {Cl} \; + \; \ text {O} _3 & \ text {ClO} \; + \; \ текст {O} _2 \\ [0.5em] \ text {ClO} \; + \; \ text {O} & \ text {Cl} \; + \; \ text {O} _2 \\ [0.5em] \ text {total \; Реакция: \; O} _3 \; + \; \ text {O} & 2 \ text {O} _2 \ end {array} [/ latex]
Один одноатомный хлор может расщепить тысячи молекул озона. К счастью, большая часть атмосферного хлора существует в виде каталитически неактивных форм Cl 2 и ClONO 2 .
После получения своей части Нобелевской премии Молина продолжил свою работу в области химии атмосферы в Массачусетском технологическом институте.
Дефицит глюкозо-6-фосфатдегидрогеназы
Ферменты в организме человека действуют как катализаторы важных химических реакций клеточного метаболизма.Таким образом, дефицит определенного фермента может привести к опасному для жизни заболеванию. Дефицит G6PD (глюкозо-6-фосфатдегидрогеназы), генетическое заболевание, которое приводит к нехватке фермента глюкозо-6-фосфатдегидрогеназы, является наиболее распространенной недостаточностью ферментов у людей. Этот фермент, показанный на рисунке 4, является ферментом, ограничивающим скорость метаболического пути, который поставляет НАДФН в клетки (рисунок 5).
Рисунок 4. Глюкозо-6-фосфатдегидрогеназа — это фермент, ограничивающий скорость метаболического пути, который поставляет НАДФН в клетки.Нарушение этого пути может привести к снижению содержания глутатиона в эритроцитах; как только весь глутатион израсходован, ферменты и другие белки, такие как гемоглобин, становятся уязвимыми. Например, гемоглобин может метаболизироваться до билирубина, что приводит к желтухе — состоянию, которое может стать серьезным. Люди, страдающие дефицитом G6PD, должны избегать определенных продуктов и лекарств, содержащих химические вещества, которые могут вызвать повреждение их эритроцитов с дефицитом глутатиона.
Рисунок 5. В механизме пентозофосфатного пути G6PD катализирует реакцию, регулирующую NAPDH, кофермент, регулирующий глутатион, антиоксидант, защищающий эритроциты и другие клетки от окислительного повреждения.Гетерогенный катализатор представляет собой катализатор, который находится в другой фазе (обычно твердой), чем реагенты. Такие катализаторы обычно функционируют, создавая активную поверхность, на которой может происходить реакция. Газовые и жидкофазные реакции, катализируемые гетерогенными катализаторами, происходят на поверхности катализатора, а не внутри газовой или жидкой фазы.
Гетерогенный катализ имеет не менее четырех этапов:
- Адсорбция реагента на поверхности катализатора
- Активация адсорбированного реагента
- Реакция адсорбированного реагента
- Диффузия продукта с поверхности в газовую или жидкую фазу (десорбция).
Любой из этих шагов может быть медленным и, таким образом, может служить шагом определения скорости. Однако в целом в присутствии катализатора общая скорость реакции выше, чем если бы реагенты находились в газовой или жидкой фазе.
На рис. 6 показаны этапы, которые, по мнению химиков, происходят в реакции соединений, содержащих двойную углерод-углеродную связь, с водородом на никелевом катализаторе. Никель — это катализатор, используемый при гидрировании полиненасыщенных жиров и масел (которые содержат несколько двойных углерод-углеродных связей) для получения насыщенных жиров и масел (которые содержат только одинарные углерод-углеродные связи).
Рис. 6. Есть четыре стадии катализа реакции C 2 H 4 + H 2 ⟶C 2 H 6 никелем.(а) Водород адсорбируется на поверхности, разрывая связи H – H и образуя связи Ni – H. (б) Этилен адсорбируется на поверхности, разрывая π-связь и образуя связи Ni – C. (c) Атомы диффундируют по поверхности и при столкновении образуют новые связи C – H. (d) C 2 H 6 молекулы уходят с поверхности никеля, так как они не сильно притягиваются к никелю.Другие важные промышленные процессы, в которых используются гетерогенные катализаторы, включают получение серной кислоты, получение аммиака, окисление аммиака до азотной кислоты и синтез метанола, CH 3 OH.Гетерогенные катализаторы также используются в каталитических нейтрализаторах большинства автомобилей с бензиновым двигателем (рис. 7).
Автомобильные каталитические преобразователи
Ученые разработали каталитические нейтрализаторы для уменьшения количества токсичных выбросов, производимых при сжигании бензина в двигателях внутреннего сгорания. Каталитические нейтрализаторы используют все пять факторов, влияющих на скорость химических реакций, чтобы обеспечить максимальную безопасность выхлопных газов.
Используя тщательно подобранную смесь каталитически активных металлов, можно добиться полного сгорания всех углеродсодержащих соединений до диоксида углерода, а также снизить выход оксидов азота.Это особенно впечатляет, если учесть, что один этап включает добавление кислорода к молекуле, а другой — удаление кислорода (рис. 7).
Рис. 7. Каталитический нейтрализатор позволяет сжигать все углеродсодержащие соединения до диоксида углерода, одновременно снижая выход оксида азота и других загрязняющих веществ в выбросы от двигателей, работающих на бензине.Большинство современных трехкомпонентных каталитических нейтрализаторов имеют поверхность, пропитанную платино-родиевым катализатором, который катализирует превращение оксида азота в диазот и кислород, а также преобразование оксида углерода и углеводородов, таких как октан, в диоксид углерода и водяной пар:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} 2 \ text {NO} _2 (g) & \ text {N} _2 (g) \; + \; 2 \ text {O} _2 (g) \\ [0.5em] 2 \ text {CO} (g) \; + \; \ text {O} _2 (g) & 2 \ text {CO} _2 (g) \\ [0.5em] 2 \ text {C} _8 \ текст {H} _ {18} (g) \; + \; 25 \ text {O} _2 (g) & 16 \ text {CO} _2 (g) \; + \; 18 \ text {H} _2 \ текст {O} (g) \ end {array} [/ latex]
Для обеспечения максимальной эффективности большинство каталитических нейтрализаторов предварительно нагревается электронагревателем. Это гарантирует, что металлы в катализаторе будут полностью активны даже до того, как выхлопные газы автомобиля станут достаточно горячими для поддержания соответствующих температур реакции.
«ChemWiki» Калифорнийского университета в Дэвисе дает подробное объяснение того, как работают каталитические нейтрализаторы.
Структура и функции фермента
Изучение ферментов — важная взаимосвязь между биологией и химией. Ферменты обычно представляют собой белки (полипептиды), которые помогают контролировать скорость химических реакций между биологически важными соединениями, особенно теми, которые участвуют в клеточном метаболизме. Различные классы ферментов выполняют множество функций, как показано в Таблице 36.
| Класс | Функция |
|---|---|
| оксидоредуктазы | окислительно-восстановительные реакции |
| трансфераз | перенос функциональных групп |
| гидролазы | реакции гидролиза |
| лиаз | отщепление группы с образованием двойных связей |
| изомеразы | изомеризация |
| лигаз | образование связи при гидролизе АТФ |
| Таблица 36. Классы ферментов и их функции | |
Молекулы фермента обладают активным центром, частью молекулы, форма которой позволяет ей связываться с определенным субстратом (молекулой реагента), образуя комплекс фермент-субстрат в качестве промежуточного продукта реакции. Есть две модели, которые пытаются объяснить, как работает этот активный сайт. Самая упрощенная модель называется гипотезой замка и ключа, которая предполагает, что молекулярные формы активного центра и субстрата дополняют друг друга и подходят друг к другу, как ключ в замке.Гипотеза индуцированной подгонки, с другой стороны, предполагает, что молекула фермента является гибкой и меняет форму, чтобы приспособиться к связи с субстратом. Однако это не означает, что активный центр фермента полностью податлив. И модель «замок-и-ключ», и модель индуцированного соответствия учитывают тот факт, что ферменты могут связываться только с определенными субстратами, поскольку в целом конкретный фермент катализирует только конкретную реакцию (рис. 8).
Рис. 8. (a) Согласно модели с замком и ключом, форма активного центра фермента идеально подходит для субстрата.(б) Согласно модели индуцированной подгонки, активный центр в некоторой степени гибок и может изменять форму, чтобы соединиться с подложкой.Королевское химическое общество представляет собой прекрасное введение в ферменты для студентов и преподавателей.
Катализаторы влияют на скорость химической реакции, изменяя ее механизм, чтобы обеспечить более низкую энергию активации. Катализаторы могут быть гомогенными (в той же фазе, что и реагенты) или гетерогенными (отличная от реагентов фаза).
Химия: упражнения в конце главы
- Учитывать увеличение скорости реакции, вызванное катализатором.
- Сравните функции гомогенных и гетерогенных катализаторов.
- Рассмотрите этот сценарий и ответьте на следующие вопросы: Атомы хлора, образующиеся в результате разложения хлорфторметанов, например CCl 2 F 2 , катализируют разложение озона в атмосфере. Один из упрощенных механизмов разложения:
[латекс] \ text {O} _3 \; {\ xrightarrow {\ text {солнечный свет}}} \; \ text {O} _2 \; + \; \ text {O} \ \ [0.5em] \ text {O} _3 \; + \; \ text {Cl} \; {\ longrightarrow} \; \ text {O} _2 \; + \; \ text {ClO} \\ [0.5em] \ text {ClO} \; + \; \ text {O} \; {\ longrightarrow} \; \ text {Cl} \; + \; \ text {O} _2 [/ latex](а) Объясните, почему атомы хлора являются катализаторами газофазного превращения:
[латекс] 2 \ text {O} _3 \; {\ longrightarrow} \; 3 \ text {O} _2 [/ latex]
(b) Оксид азота также участвует в разложении озона по механизму:
[латекс] \ text {O} _3 \; {\ xrightarrow {\ text {солнечный свет}}} \; \ text {O} _2 \; + \; \ text {O} \\ [0.5em] \ text {O} _3 \; + \; \ text {NO} \; {\ longrightarrow} \; \ text {NO} _2 \; + \; \ text {O} _2 \\ [0.5em] \ текст {NO} _2 \; + \; \ text {O} \; {\ longrightarrow} \; \ text {NO} \; + \; \ text {O} _2 [/ latex]
Является ли NO катализатором разложения? Поясните свой ответ.
- Для каждой из следующих пар диаграмм реакций укажите, какая из пары катализируется:
(а)
б)
- Для каждой из следующих пар диаграмм реакций укажите, какая из пар катализируется:
(а)
б)
- Для каждой из следующих диаграмм реакций оцените энергию активации ( E a ) реакции:
(а)
б)
- Для каждой из следующих диаграмм реакций оцените энергию активации ( E a ) реакции:
(а)
б)
- На основании диаграмм в упражнении 6 «Химия» в конце главы, какая из реакций протекает быстрее всего? У кого самая низкая скорость?
- На основании диаграмм в упражнении 7 «Химия» в конце главы, какая из реакций протекает быстрее всего? У кого самая низкая скорость?
Глоссарий
- гетерогенный катализатор Катализатор
- присутствует в фазе, отличной от фазы реагентов, обеспечивая поверхность, на которой может происходить реакция
- гомогенный катализатор Катализатор
- присутствует в той же фазе, что и реагенты
Решения
Ответы к упражнениям в конце главы по химии
1.Общий способ действия катализатора заключается в обеспечении механизма, с помощью которого реагенты могут легче объединяться, выбирая путь с более низкой энергией реакции. Скорость как прямой, так и обратной реакции увеличивается, что приводит к более быстрому достижению равновесия.
3. (a) Атомы хлора являются катализатором, потому что они реагируют на второй стадии, но регенерируются на третьей стадии. Таким образом, они не расходуются, что характерно для катализаторов. (б) NO является катализатором по той же причине, что и в части (а).
5. Понижение энергии переходного состояния указывает на действие катализатора. а) А; (б) B
7. Энергия, необходимая для перехода из начального состояния в переходное, составляет: а) 10 кДж; (б) 10 кДж
9. У обоих одинаковая энергия активации, поэтому у них одинаковая скорость.
Что делает катализатор в химической реакции?
Когда вы используете стиральный порошок, чтобы избавиться от пятна на рубашке, вы видите катализатор в действии во время химической реакции.Моющие средства содержат ферменты, которые являются катализаторами, разрушающими грязь и другие пятна на одежде. Хотя они помогают очистить любимую одежду людей, они не единственные примеры мощных катализаторов.
TL; DR (слишком долго; не читал)
Катализатор ускоряет химическую реакцию. Катализатор остается неизменным после реакции.
Влияние катализатора на химическую реакцию
Катализатор влияет на химическую реакцию, ускоряя ее. Он также предлагает альтернативный способ возникновения реакции, который снижает количество необходимой энергии.Для начала реакции требуется энергия активации, и катализаторы могут помочь. Однако катализаторы выживают в реакциях в неизменном виде.
Двусторонние катализаторы влияют на химическую реакцию
Катализаторы влияют на химические реакции двумя основными способами: путем снижения энергии активации или путем изменения протекания реакции. Они могут снизить энергию переходного состояния, поэтому общая энергия активации, необходимая для реакции, уменьшается, или они могут изменять механизмы реакции и, таким образом, изменять переходное состояние.
Катализаторы выполняют свою работу по-разному. Один из вариантов заключается в том, чтобы эти вещества позволяли молекулам реагентов разорвать свои связи и образовать новые с катализаторами. Эти связи не являются постоянными, поэтому катализаторы могут выдерживать реакции без изменений. Другой способ работы катализаторов — изменение конфигурации реагентов и ослабление их связей.
Примеры катализаторов в химических реакциях
Два типа катализаторов — гомогенные и гетерогенные.Гомогенные катализаторы существуют в той же фазе, что и реагенты химической реакции. Например, если реагентами являются газы, то катализатор также является газом. Гетерогенные катализаторы находятся в другой фазе, чем реагенты. Например, реагенты могут быть твердыми, но катализатор — жидким.
Ферменты — типичный пример биологического катализатора. Эти белки могут складываться по-разному, чтобы способствовать реакциям путем связывания реагентов. Катализаторы могут помочь гидролизу сахарозы или столового сахара.Инвертаза — это фермент, который помогает расщеплять сахарозу: сахароза + h3O дает глюкозу + фруктозу.
Каталитические нейтрализаторы в автомобилях — еще один распространенный пример того, как работают катализаторы. Катализаторы внутри конвертеров, как правило, представляют собой драгоценные металлы, такие как платина или родий. Газы попадают в конвертер и контактируют с катализаторами. Затем вредные загрязнители вступают в реакцию с металлами и становятся менее токсичными.
Катализ
14.8 Катализ
Цель обучения
- Чтобы понять, как катализаторы увеличивают скорость реакции и селективность химических реакций.
Глава 3 «Химические реакции» описывает катализаторы: вещество, которое участвует в реакции и заставляет ее протекать быстрее, но которое может быть восстановлено без изменений в конце реакции и повторно использовано. Катализаторы также могут контролировать, какие продукты образуются в реакции. как вещества, которые увеличивают скорость химической реакции, но не расходуются в процессе. Катализатор, следовательно, не входит в общую стехиометрию реакции, которую он катализирует, но должен присутствовать по крайней мере в одной из элементарных реакций в механизме катализируемой реакции.Катализированный путь имеет более низкое значение E a , но чистое изменение энергии в результате реакции (разница между энергией реагентов и энергией продуктов) составляет , а не , на которое влияет присутствие катализатора (рис. 14.26 «Снижение энергии активации реакции катализатором»). Тем не менее, из-за более низкого значения E a скорость реакции катализированной реакции выше, чем скорость реакции некаталитической реакции при той же температуре.Поскольку катализатор уменьшает высоту энергетического барьера, его присутствие увеличивает скорость реакции , , прямую, и , обратную на одинаковую величину. В этом разделе мы рассмотрим три основных класса катализаторов: гетерогенные катализаторы, гомогенные катализаторы и ферменты .
Обратите внимание на узор
Катализатор влияет на E a , а не на Δ E .
Рисунок 14.26 Понижение энергии активации реакции катализатором
На этом графике сравниваются диаграммы потенциальной энергии для одностадийной реакции в присутствии и в отсутствие катализатора. Единственный эффект катализатора — снижение энергии активации реакции. Катализатор не влияет на энергию реагентов или продуктов (и, следовательно, не влияет на Δ E ).
Гетерогенный катализ
При гетерогенном катализе Каталитическая реакция, в которой катализатор находится в фазе, отличной от фазы реагентов., катализатор находится в фазе, отличной от фазы реагентов. По крайней мере, один из реагентов взаимодействует с твердой поверхностью в физическом процессе, называемом адсорбция , таким образом, что химическая связь в реагенте становится слабой, а затем разрывается. Яды — это вещества, которые необратимо связываются с катализаторами, предотвращая адсорбцию реагентов и, таким образом, снижая или разрушая эффективность катализатора.
Примером гетерогенного катализа является взаимодействие газообразного водорода с поверхностью металла, такого как Ni, Pd или Pt.Как показано в части (а) на рисунке 14.27 «Гидрирование этилена на гетерогенном катализаторе», водородно-водородные связи разрываются и образуют отдельные адсорбированные атомы водорода на поверхности металла. Поскольку адсорбированные атомы могут перемещаться по поверхности, два атома водорода могут сталкиваться и образовывать молекулу газообразного водорода, которая затем может покинуть поверхность в обратном процессе, называемом десорбцией . Адсорбированные атомы H на поверхности металла значительно более активны, чем молекулы водорода.Поскольку относительно прочная связь H – H (энергия диссоциации = 432 кДж / моль) уже разорвана, энергетический барьер для большинства реакций H 2 на поверхности катализатора существенно ниже.
Рисунок 14.27. Гидрирование этилена на гетерогенном катализаторе
Когда молекула водорода адсорбируется на поверхности катализатора, связь H – H разрывается, и образуются новые связи M – H. Отдельные атомы H более реакционноспособны, чем газообразный H 2 .Когда молекула этилена взаимодействует с поверхностью катализатора, она вступает в реакцию с атомами H в ступенчатом процессе с образованием этана, который высвобождается.
На рисунке 14.27 «Гидрирование этилена на гетерогенном катализаторе» показан процесс, называемый гидрирование , в котором атомы водорода добавляются к двойной связи алкена, такого как этилен, с получением продукта, содержащего одинарные связи C – C, в данном случае этан. Гидрирование используется в пищевой промышленности для преобразования растительных масел, состоящих из длинных цепочек алкенов, в более коммерчески ценные твердые производные, содержащие алкильные цепи.Гидрирование некоторых двойных связей в полиненасыщенных растительных маслах, например, дает маргарин, продукт с температурой плавления, текстурой и другими физическими свойствами, подобными маслу.
Несколько важных примеров промышленных гетерогенных каталитических реакций приведены в Таблице 14.8 «Некоторые коммерчески важные реакции, в которых используются гетерогенные катализаторы». Хотя механизмы этих реакций значительно сложнее описанной здесь простой реакции гидрирования, все они включают адсорбцию реагентов на твердой каталитической поверхности, химическую реакцию адсорбированных частиц (иногда через ряд промежуточных частиц) и, наконец, десорбцию. изделий с поверхности.
Таблица 14.8 Некоторые коммерчески важные реакции с использованием гетерогенных катализаторов
| Коммерческий процесс | Катализатор | Начальная реакция | Готовый коммерческий продукт |
|---|---|---|---|
| контактный процесс | V 2 O 5 или Pt | 2SO 2 + O 2 → 2SO 3 | H 2 SO 4 |
| Процесс Хабера | Fe, K 2 O, Al 2 O 3 | N 2 + 3H 2 → 2NH 3 | NH 3 |
| процесс Оствальда | Pt и Rh | 4NH 3 + 5O 2 → 4NO + 6H 2 O | HNO 3 |
| реакция конверсии вода-газ | Fe, Cr 2 O 3 или Cu | CO + H 2 O → CO 2 + H 2 | H 2 для NH 3 , CH 3 OH и других видов топлива |
| паровой риформинг | Ni | CH 4 + H 2 O → CO + 3H 2 | H 2 |
| синтез метанола | ZnO и Cr 2 O 3 | CO + 2H 2 → CH 3 OH | СН 3 ОН |
| Процесс Sohio | фосфомолибдат висмута | Ch3 = CHCh4 + Nh4 + 32O2 → Ch3 = CHCN + 3h3O | Ch3 = CHCNacrylonitrile |
| каталитическое гидрирование | Ni, Pd или Pt | RCH = CHR ′ + H 2 → RCH 2 -CH 2 R ′ | частично гидрогенизированные масла для маргарина и т. Д. |
Гомогенный катализ
В гомогенном катализе Каталитическая реакция, в которой катализатор равномерно диспергирован по смеси реагентов с образованием раствора., катализатор находится в той же фазе, что и реагент (ы). Число столкновений между реагентами и катализатором максимально, поскольку катализатор равномерно диспергирован по всей реакционной смеси. Многие гомогенные катализаторы в промышленности представляют собой соединения переходных металлов (таблица 14.9 «Некоторые коммерчески важные реакции, в которых используются гомогенные катализаторы»), но извлечение этих дорогостоящих катализаторов из раствора было серьезной проблемой. В качестве дополнительного барьера к их широкому коммерческому использованию многие гомогенные катализаторы можно использовать только при относительно низких температурах, и даже в этом случае они имеют тенденцию медленно разлагаться в растворе.Несмотря на эти проблемы, в последние годы был разработан ряд коммерчески жизнеспособных процессов. Полиэтилен высокой плотности и полипропилен производятся методом гомогенного катализа.
Таблица 14.9 Некоторые коммерчески важные реакции с использованием гомогенных катализаторов
| Коммерческий процесс | Катализатор | Реагенты | Конечный продукт |
|---|---|---|---|
| Union Carbide | [Rh (CO) 2 I 2 ] — | CO + CH 3 OH | CH 3 CO 2 H |
| гидропероксидный процесс | Комплексы Mo (VI) | CH 3 CH = CH 2 + R – O – O – H | |
| гидроформилирование | Rh / PR 3 комплексов | RCH = CH 2 + CO + H 2 | RCH 2 CH 2 CHO |
| адипонитрил процесс | Ni / PR 3 комплексов | 2HCN + CH 2 = CHCH = CH 2 | NCCH 2 CH 2 CH 2 CH 2 CN, используемый для синтеза нейлона |
| полимеризация олефинов | (RC 5 H 5 ) 2 ZrCl 2 | Канал 2 = Канал 2 | — (CH 2 CH 2 -) n : полиэтилен высокой плотности |
Ферменты
Ферменты , катализаторы, встречающиеся в естественных условиях в живых организмах, представляют собой почти все белковые молекулы с типичной молекулярной массой 20 000–100 000 а.е.м.Некоторые из них представляют собой гомогенные катализаторы, которые вступают в реакцию в водном растворе в клеточном отделении организма. Другие представляют собой гетерогенные катализаторы, встроенные в мембраны, которые отделяют клетки и клеточные компартменты от их окружения. Реагент в реакции, катализируемой ферментами, называется субстратом Реагент в реакции, катализируемой ферментами ..
Поскольку ферменты могут увеличивать скорость реакции в огромных количествах (до 10 17 раз по сравнению с некаталитической скоростью) и имеют тенденцию быть очень специфичными, обычно производя только один продукт с количественным выходом, они являются предметом активных исследований.В то же время ферменты обычно дороги в получении, они часто перестают функционировать при температурах выше 37 ° C, имеют ограниченную стабильность в растворе и обладают такой высокой специфичностью, что ограничиваются превращением одного конкретного набора реагентов в один конкретный продукт. . Это означает, что для химически подобных реакций необходимо разрабатывать отдельные процессы с использованием разных ферментов, что отнимает много времени и является дорогостоящим. К настоящему времени ферменты нашли лишь ограниченное промышленное применение, хотя они используются в качестве ингредиентов в моющих средствах для стирки, средствах для чистки контактных линз и размягчителях мяса.Ферменты в этих приложениях, как правило, представляют собой протеазы , которые способны расщеплять амидные связи, удерживающие вместе аминокислоты в белках. Например, размягчители мяса содержат протеазу под названием папаин, которую выделяют из сока папайи. Он расщепляет некоторые длинные волокнистые молекулы белка, которые делают недорогие нарезы говядины жесткими, в результате чего получается более нежный кусок мяса. Некоторые насекомые, такие как жук-бомбадир, несут фермент, способный катализировать разложение перекиси водорода до воды (Рисунок 14.28 «Механизм каталитической защиты»).
Ингибиторы ферментов: Вещества, которые снижают скорость реакции, катализируемой ферментами, путем связывания с определенной частью фермента, таким образом замедляя или предотвращая возникновение реакции. вызывают снижение скорости реакции, катализируемой ферментом, путем связывания с определенной частью фермента и, таким образом, замедления или предотвращения реакции. Поэтому необратимые ингибиторы являются эквивалентом ядов в гетерогенном катализе.Одним из старейших и наиболее широко используемых коммерческих ингибиторов ферментов является аспирин, который избирательно подавляет один из ферментов, участвующих в синтезе молекул, вызывающих воспаление. Создание и синтез родственных молекул, более эффективных, более селективных и менее токсичных, чем аспирин, являются важными задачами биомедицинских исследований.
Рисунок 14.28 Механизм каталитической защиты
Обжигающий спрей с неприятным запахом, исходящий от этого жука-бомбардира, образуется в результате каталитического разложения H 2 O 2 .
Резюме
Катализаторы участвуют в химической реакции и увеличивают ее скорость. Они не входят в общее уравнение реакции и не расходуются в ходе реакции. Катализаторы позволяют реакции протекать по пути, который имеет более низкую энергию активации, чем некаталитическая реакция. В гетерогенном катализе катализаторы обеспечивают поверхность, с которой реагенты связываются в процессе адсорбции. В гомогенном катализе катализаторы находятся в той же фазе, что и реагенты. Ферменты — это биологические катализаторы, которые приводят к значительному увеличению скорости реакции и имеют тенденцию быть специфичными для определенных реагентов и продуктов. Реагент в реакции, катализируемой ферментами, называется субстратом . Ингибиторы ферментов вызывают снижение скорости реакции, катализируемой ферментами.
Key Takeaway
- Катализаторы позволяют реакции протекать по пути, который имеет более низкую энергию активации.
Концептуальные проблемы
Как катализатор влияет на энергию активации реакции? Как это влияет на частотный фактор ( A )? Как это влияет на изменение потенциальной энергии реакции?
Как можно повлиять на распределение продуктов реакции с помощью катализатора?
Гетерогенный катализатор работает путем взаимодействия с реагентом в процессе, называемом адсорбция .Что происходит во время этого процесса? Объясните, как это может снизить энергию активации.
Как влияет увеличение площади поверхности гетерогенного катализатора на реакцию? Влияет ли увеличение площади поверхности на энергию активации? Поясните свой ответ.
Определите различия между гетерогенным катализатором и гомогенным катализатором с точки зрения следующего.
- простота восстановления
- частота столкновений
- температурная чувствительность
- стоимость
Область интенсивных химических исследований включает разработку гомогенных катализаторов, хотя гомогенные катализаторы обычно имеют ряд эксплуатационных трудностей.Предложите одну или две причины, по которым может быть предпочтительнее гомогенный катализатор.
Рассмотрим следующую реакцию между ионами церия (IV) и таллия (I):
2Ce 4+ + Tl + → 2Ce 3+ + Tl 3+Эта реакция протекает медленно, но Mn 2+ катализирует ее, как показано в следующем механизме:
Ce 4+ + Mn 2+ → Ce 3+ + Mn 3+ Ce 4+ + Mn 3+ → Ce 3+ + Mn 4+ Mn 4+ + Tl + → Tl 3+ + Mn 2+Каким образом Mn 2+ увеличивает скорость реакции?
В тексте указывается несколько факторов, ограничивающих промышленное применение ферментов.Тем не менее, существует большой интерес к пониманию того, как работают ферменты, для создания катализаторов для промышленного применения. Почему?
Большинство ферментов имеют оптимальный диапазон pH; однако следует соблюдать осторожность при определении влияния pH на активность ферментов. Снижение активности может быть связано с влиянием изменений pH на группы в каталитическом центре или с воздействием на группы, расположенные в другом месте фермента.Оба примера наблюдаются в химотрипсине, пищеварительном ферменте, который является протеазой, гидролизующей полипептидные цепи. Объясните, как изменение pH может повлиять на каталитическую активность из-за (а) эффектов в каталитическом центре и (б) эффектов в других частях фермента. ( Подсказка : помните, что ферменты состоят из функциональных аминокислот.)
ответы
Катализатор снижает энергию активации реакции.Некоторые катализаторы также могут ориентировать реагенты и тем самым увеличивать частотный фактор. Катализаторы не влияют на изменение потенциальной энергии реакции.
При адсорбции реагент плотно связывается с поверхностью. Поскольку межмолекулярные взаимодействия между поверхностью и реагентом ослабляют или разрывают связи в реагенте, его реакционная способность увеличивается, а энергия активации реакции часто снижается.
- Гетерогенные катализаторы легче восстановить.
- Частота столкновений больше для гомогенных катализаторов.
- Гомогенные катализаторы часто более чувствительны к температуре.
- Гомогенные катализаторы часто дороже.
Ион Mn 2+ отдает два электрона Ce 4+ по одному, а затем принимает два электрона от Tl + . Поскольку Mn может существовать в трех степенях окисления, разделенных одним электроном, он способен связывать одноэлектронные и двухэлектронные реакции переноса.
Числовые задачи
В какой-то момент во время ферментативной реакции концентрация активированного комплекса, называемого комплексом фермент-субстрат (ES), и других промежуточных продуктов, участвующих в реакции, почти постоянна.Когда задействован единственный субстрат, реакция может быть представлена следующей последовательностью уравнений:
фермент (E) + субстрат (S) ⇌ фермент-субстратный комплекс (ES) ⇌ фермент (E) + продукт (P)Это также можно отобразить следующим образом:
E + S⇌k − 1k1ES⇌k − 2k2E + PИспользуя молярные концентрации и константы скорости, запишите выражение для скорости исчезновения комплекса фермент-субстрат.Обычно концентрации ферментов невелики, а концентрации субстрата высоки. Если бы вы определяли закон скорости, варьируя концентрацию субстрата в этих условиях, каков был бы ваш очевидный порядок реакции?
Было обнаружено, что конкретная реакция протекает по следующему механизму:
А + В → С + D 2C → E E + A → 3B + FКакова общая реакция? Является ли эта реакция каталитической, и если да, то какой вид катализатора? Определите промежуточные звенья.
У конкретной реакции есть два доступных пути (A и B), каждый из которых способствует превращению X в другой продукт ( Y и Z соответственно). В некаталитических условиях путь A предпочтителен, но в присутствии катализатора путь B предпочтителен. Путь B обратим, а путь A — нет. Какой продукт предпочтительнее в присутствии катализатора? без катализатора? Нарисуйте диаграмму, показывающую, что происходит с катализатором и без него.
Кинетику реакции, катализируемой ферментами, можно проанализировать, построив график зависимости скорости реакции от концентрации субстрата. Этот тип анализа называется лечением Михаэлиса – Ментен. При низких концентрациях субстрата график показывает поведение, характерное для кинетики первого порядка, но при очень высоких концентрациях субстрата поведение показывает кинетику нулевого порядка.Объясните этот феномен.
ответы
Δ [ES] Δt = — (k2 + k − 1) [ES] + k1 [E] [S] + k − 2 [E] [P] ≈0; нулевой порядок в подложке.
В обоих случаях предпочтение отдается продукту пути А.Все Z , полученные по катализированному обратимому пути B, в конечном итоге будут преобразованы в X , поскольку X необратимо преобразуются в Y по пути A.
Z⇌BX → AY
Новая теория показывает, как деформация улучшает катализаторы
Push and pull: Исследователи из Университета Брауна показали, что влияние внешней деформации на катализатор зависит от внутренней деформации, создаваемой химическими реагентами.Эта новая теоретическая основа может быть полезна при оптимизации катализаторов для различных реакций. Лаборатория Петерсона / Университет БраунаPROVIDENCE, R.I. [Университет Брауна] — Исследователи из Университета Брауна разработали новую теорию, объясняющую, почему растяжение или сжатие металлических катализаторов может улучшить их работу. Теория, описанная в журнале Nature Catalysis, может открыть новые возможности для разработки новых катализаторов с новыми возможностями.
Катализаторы — это вещества, ускоряющие химические реакции.Подавляющее большинство промышленного катализа включает твердые поверхности, часто металлы, которые катализируют реакции в жидкостях или газах. Каталитический нейтрализатор на автомобиле, например, использует металлические катализаторы для удаления токсинов из выхлопных газов. Также есть интерес к использованию металлических катализаторов для превращения диоксида углерода в топливо, изготовления удобрений из атмосферного азота и стимулирования реакций в автомобилях с топливными элементами.
Исследования последних лет показали, что приложение деформации к металлическим катализаторам — сжатие или растяжение — может в некоторых случаях изменить способ их работы.
«Штамм — действительно актуальная тема для катализа прямо сейчас», — сказал Эндрю Петерсон, доцент инженерной школы Брауна и соавтор исследования. «Мы начинаем видеть вещи, происходящие под напряжением, которые нелегко объяснить традиционной теорией работы катализаторов. Это заставило нас задуматься об альтернативной структуре для этого вопроса ».
Металлический катализатор работает, заставляя реагенты связываться с его поверхностью, процесс, известный как адсорбция. Адсорбция разрывает химические связи молекул реагентов, позволяя различным стадиям химической реакции протекать на поверхности металла.После завершения стадий реакции конечный продукт выделяется из катализатора посредством обратного процесса, называемого десорбцией.
Ключевым свойством катализатора является его реакционная способность, означающая, насколько прочно он связывает химические молекулы со своей поверхностью. Катализаторы должны быть в некоторой степени реактивными, чтобы произошло связывание, но не слишком реактивными. Слишком высокая реакционная способность приводит к тому, что катализатор слишком плотно удерживает молекулы, что может затруднить некоторые стадии реакции или сделать так, чтобы конечные продукты не могли десорбироваться.
В последние годы было показано, что приложение напряжения к катализатору может регулировать его реакционную способность, и существует хорошо обоснованная теория того, как он работает. Вообще говоря, теория предсказывает, что деформация растяжения должна увеличивать реактивность, а сжатие — уменьшать ее. Однако Петерсон и его группа продолжали сталкиваться с системами, которые нелегко объяснить с помощью теории.
Это заставило исследователей задуматься о новом взгляде на проблему. Традиционная теория описывает вещи на уровне электронов и электронных зон.Новая теория немного уменьшает масштаб, вместо этого сосредотачиваясь на механике взаимодействия молекул с атомной решеткой катализатора.
Петерсон и его команда показали, что молекулы, связанные с поверхностью катализатора, будут стремиться либо раздвигать атомы в решетке, либо сближать их, в зависимости от характеристик молекул и мест связывания. Различные силы, создаваемые молекулами, имеют интересные последствия для того, как внешняя деформация должна влиять на реактивность катализатора.Это предполагает, что натяжение, которое растягивает атомную решетку катализатора, должно сделать катализатор более реактивным по отношению к молекулам, которые естественным образом хотят раздвинуть решетку. В то же время натяжение должно снизить реакционную способность молекул, которые хотят стянуть решетку вместе. Сжатие — сжатие решетки — имеет обратный эффект.
Новая теория не только помогает объяснить ранее озадачивающие результаты, но и делает новые важные прогнозы. В частности, он предсказывает способ разрушения традиционных масштабных соотношений между катализаторами и различными типами молекул.
«Соотношения масштабирования означают, что при нормальных обстоятельствах, когда вы увеличиваете реакционную способность катализатора для одного химического вещества, это увеличивает реакционную способность также и для других химикатов», — сказал Петерсон. «Точно так же, если вы уменьшите реактивность для одного химического вещества, вы уменьшите ее для других».
Эти отношения масштабирования приводят к трудным компромиссам при попытке оптимизировать катализатор. Получение идеальной реакционной способности для одного химического вещества может привести к тому, что другое химическое вещество будет связываться слишком сильно (или слишком слабо), потенциально ингибируя некоторые стадии реакции.Но эта новая теория предполагает, что деформация может нарушить эти масштабные соотношения, позволяя катализатору одновременно связывать одно химическое вещество более плотно, а другое — более свободно, в зависимости от естественного взаимодействия химического вещества с атомной решеткой катализатора и способа создания поля деформации на поверхности. поверхность катализатора.
«Теперь вы можете начать думать о действительно тонкой настройке катализаторов, чтобы они лучше работали на разных стадиях реакции», — сказал Петерсон. «Это может значительно улучшить характеристики катализатора, в зависимости от используемых химикатов.”
Команда Петерсона начала составлять базу данных по обычным химическим веществам и их взаимодействиям с различными поверхностями катализаторов. Эта база данных может служить руководством для поиска реакций, которые могут выиграть от напряжения и нарушения масштабных соотношений.
Тем временем Петерсон надеется, что проделанная ими работа предоставит этому каталитическому сообществу новый образ мышления о напряжении.
«Мы пытаемся дать структуру, которая обеспечивает более интуитивное понимание того, как деформация работает в катализе», — сказал Петерсон.«Поэтому, когда люди разрабатывают новые катализаторы, они могут придумать способы лучше использовать эти эффекты напряжения».
Исследование было поддержано Исследовательским бюро армии США (W911NF-11-10353). Другими авторами статьи были Алиреза Хоршиди, Джеймс Вайолет и Джавад Хашеми.
.
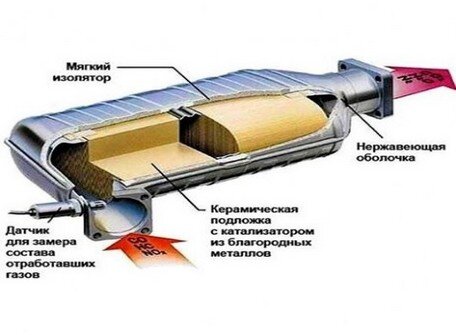
 Выполняет функции теплоизоляции и защиты катализатора от механических повреждений.
Выполняет функции теплоизоляции и защиты катализатора от механических повреждений.