Влияние ортофосфорной кислоты на организм. Применение ортофосфорной кислоты от ржавчины
Уже никого не удивишь длинным списком добавок, обнаруженным на упаковке продуктов питания. Все они в какой-то мере способны оказать неблагоприятное воздействие на наш организм, вызвав аллергические реакции или отравление. И такое неорганическое соединение, как ортофосфорная кислота, применяемое в пищевой промышленности в роли антиоксиданта и регулятора кислотности, входит в их число. Определяется она, как маркер Е338.
Характеристика вещества
Ортофосфорная кислота, или добавка Е338, являет собою бесцветные кристаллы. Ее основные характеристики будут следующими:
- полное отсутствие окислительных и восстановительных свойств;
- в воде и этаноле растворима хорошо;
- класс опасности ортофосфорной кислоты — 2;
- при температуре 42,35°C начинается процесс ее плавления, в результате которого кристаллы преобразуются в вязкую бесцветную прозрачную жидкость;
- температура кипения составляет 158°C;
- при повышении температуры до 213°C и выше происходит ее превращение в пирофосфорную кислоту.

Влияние на организм
Добавка Е338 интенсивно используется в пищевой промышленности во многих странах мира. Однако научные исследования показали, что ортофосфорная кислота оказывает негативное влияние на организм человека и проявляется это следующим образом:
ЛЕЧИТЕ ПРИЧИНУ, А НЕ СЛЕДСТВИЕ! Средство из природных компонентов Nutricomplex восстанавливает правильный обмен веществ за 1 месяц.
- нарушается кислотно-щелочной баланс, вследствие чего происходит повышение кислотности, а это чревато развитием раннего остеопороза и кариеса;
- при чрезмерном употреблении продуктов питания, в состав которых входит добавка Е338, может развиться отвращение к пище и как следствие – снижение массы тела;
- при остром отравлении ортофосфорной кислотой возникают такие симптомы, как рвота, диарея, головные боли, головокружение и затрудненное дыхание.
На заметку! Попадая на открытые участки кожи, ортофосфорная кислота вызывает ожоги, на слизистую глаз – жжение, при вдыхании начинаются приступы сильного кашля.
Ее пары при длительном воздействии раздражают слизистую носа, что приводит к носовому кровотечению и возбуждению атрофических процессов, в редких случаях это чревато изменением формулы крови и разрушением зубов! Однако это возможно только при работе с данным веществом в чистом виде. В бытовых условиях при контакте с продуктами питания, в состав которых входит данная добавка, такие последствия невозможны!
Применение
Ортофосфорная кислота нашла применение в разных отраслях, но наиболее востребованной она стала в сфере медицины и пищевой промышленности.
Медицина
В незначительных количествах это вещество добавляют в смеси, которые используется для отбеливания зубной эмали. Однако наиболее часто ее применяют перед процедурой пломбирования, протравливая с ее помощью поверхность зуба.
Важно! Но даже во время стоматологических процедур ортофосфорная кислота способна причинить вред – если данное вещество даже в незначительном количестве останется на поверхности зуба, то это может привести к образованию так называемой кислотной мины, когда через некоторое время после лечения зуб попросту раскалывается на мелкие части!
Пищевая промышленность
Пищевая добавка Е338 – это антиоксидант, который помогает сохранить цвет продукта, защищая его от окисления. Также ее добавляют в некоторые напитки и продукты для придания им кисловатого привкуса. Ортофосфорная кислота встречается в:
Также ее добавляют в некоторые напитки и продукты для придания им кисловатого привкуса. Ортофосфорная кислота встречается в:
- кока-коле, пепси, спрайте и прочих ароматизированных напитках;
- колбасных изделиях;
- плавленых сырках;
- хлебопекарных порошках.
На заметку! Казалось бы, почему не подкислить продукты, используя лимонную кислоту, которая является натуральной и практически безвредной? И, возможно, что производители так бы и сделали, но ортофосфорная кислота отличается более низкой стоимостью и легкостью получения!
Вы – одна из тех миллионов женщин, которые борются с лишним весом?
А все ваши попытки похудеть не увенчались успехом?
И вы уже задумывались о радикальных мерах? Оно и понятно, ведь стройная фигура — это показатель здоровья и повод для гордости. Кроме того, это как минимум долголетие человека. А то, что человек, теряющий «лишние килограммы» , выглядит моложе – аксиома не требующая доказательств.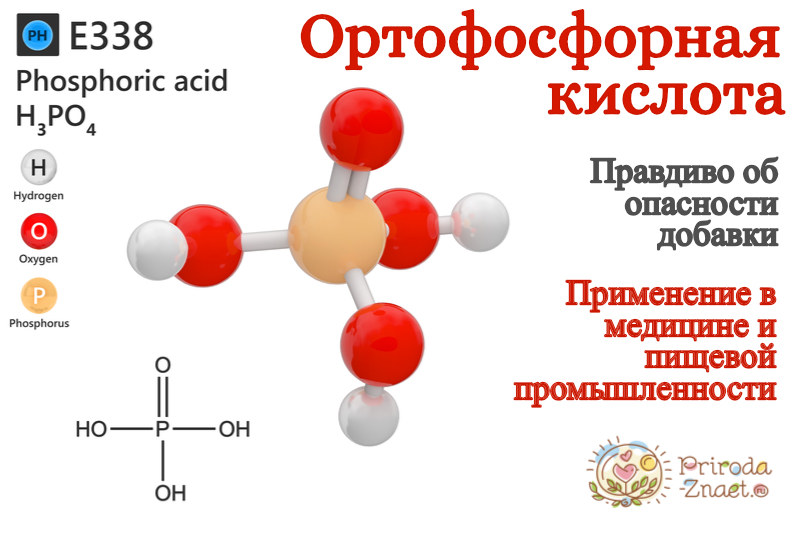
Ржавчина является опасной болезнью для металла, она появляется от реакции кислорода и углекислого газа с водой. При первоначальном появлении ржавых пятен на металле, его необходимо зачистить, и обработать защитным средством. Можно производить очистку химического вида с помощью ортофосфорной кислоты.
Ортофосфорной кислотой является порошок, который разводится водой, используется в различной промышленности, а также медицине. Кислоту применяют в разведенном виде, 85% водного раствора, который не имеет едкого запаха. Кислоту используют в производстве бытовых средств, которые применяются для удаления ржавчины. Также её добавляют в грунтовочные смеси для металла. После обработки поверхности ортофосфорной кислотой, образуется защитный слой, который предотвращает материал от разрушения.
Основные правила предосторожности при работе с ортофосфорной кислотой
При удалении ржавчины химическим способом, необходимо обезопасить дыхательные пути и руки, для этого используют респиратор и перчатки. Так как испарение кислоты может вызвать ожоги дыхательных путей, и кожи. Помимо этого средство является пожароопасным, поэтому при работе необходимо обеспечить хорошее проветривание в помещении.
Если кислота попала на кожу, необходимо сразу обильно промыть это место водой, это делают около 15 минут. При значительном повреждении, нужно немедленно посетить больницу. Запрещается вытир
Так как испарение кислоты может вызвать ожоги дыхательных путей, и кожи. Помимо этого средство является пожароопасным, поэтому при работе необходимо обеспечить хорошее проветривание в помещении.
Если кислота попала на кожу, необходимо сразу обильно промыть это место водой, это делают около 15 минут. При значительном повреждении, нужно немедленно посетить больницу. Запрещается вытир
Ортофосфорная кислота: применение от ржавчины
В быту у нас порой случается так, что для удаления пятен ржавчины нам приходится пользоваться такими подручными средствами как соль и лимон, сода и картофельный сок в соединении с мыльным раствором и многое другое. Это чаще касается ткани и посуды. Результат иногда превосходит наши ожидания, и мы рекомендуем свой простой рецепт друзьям и знакомым, столкнувшимся с подобной ситуацией.
Но что делать тем, у кого ржавчина «поела» не кусок ткани, а предположим, автомобильный кузов, диск или предметы сантехники? Здесь приходится обращаться к более сильным и профессиональным средствам, к таким средствам относится ортофосфорная кислота для применения от ржавчины.
Под воздействием воды, кислорода, углекислого газа металлическая поверхность подвергается окислению, в результате чего на ней образуется слой ржавчины. Если вовремя не провести чистку металлических предметов или их деталей, то коррозия со временем может не только повредить металлическую поверхность, но и полностью ее разрушить.
Чтобы очистить металл, можно применить механическую обработку, а можно использовать различные химические средства, одним из которых является ортофосфорная кислота. Это вещество, относящееся к неорганическим соединениям, представляющим из себя 85-процентный сиропообразный водяной раствор, без цвета и запаха.
Применение ортофосфорной кислоты от ржавчины в быту
Ортофосфорная кислота подходит для всех металлических поверхностей. Она, благодаря своей консистенции, отлично их обволакивает, не просто уничтожая ржавчину, но и создавая защитную пленку, которая препятствует дальнейшему расползанию коррозии. Ортофосфорная кислота нашла широкое применение у автомобилистов, в авиации, в пищевой промышленности и даже в стоматологии.

Положительные свойства ортофосфорной кислоты:
1. Эффективно удаляются пятна ржавчины не только на металлических, но и на эмалированных поверхностях.
2. Вещество действует «щадяще», оставляя здоровую поверхность не поврежденной.
3. Обладает функциями защиты, создавая защитную пленку на металлической поверхности.
Ортофосфорная кислота: способы применения от ржавчины
1. Путем погружения в нее предмета, требующего очистки от ржавчины.
2. Путем нанесения кислоты на очищаемую поверхность.
Способ No1.
Первый способ используется тогда, когда предмет имеет большие размеры или является съемной деталью какого либо предмета. Такой предмет или деталь можно целиком погрузить в кислоту, делая это неоднократно до достижения нужного результата. Перед тем как приступить к работе необходимо провести несколько подготовительных процедур, первой и очень важной из которых является очищение предмета от грязевого и пыльного налета.
Погружение предмета в ортофосфорную кислоту
Следующим этапом работы станет процесс подготовки емкости для кислоты. Сначала эту емкость обезжиривают, затем тщательно промывают водой. После этого в емкость набирают воду и добавляют кислоту из расчета на 1 литр воды 100 мл кислоты. Металлическую деталь погружают в раствор и выдерживают примерно час, не забывая постоянно помешивать, чтобы раствор действовал равномерно.
На следующем этапе обработки деталь промывают и опускают в раствор, состоящий из 50 процентов воды, 48 процентов обычного и 2 процентов нашатырного спирта. Затем деталь снова промывается и высушивается. Каждый этап работы очень важен и ни одного из них не следует пропускать. Например,
обезжиривание предмета позволяет кислоте действовать равномерно, а тщательная просушка будет препятствовать образованию новой ржавчины.
Способ No2.
Второй способ применения ортофосфорной кислоты заключается в непосредственном нанесении ее на сам предмет или его деталь. Этот способ уместно применять в том случае, когда предмет не имеет больших размеров. Для нанесения кислоты используются кисточка или валик.
Этот способ уместно применять в том случае, когда предмет не имеет больших размеров. Для нанесения кислоты используются кисточка или валик.
Далее весь подготовительный процесс проходит точно так же, как и в случае полного погружения предмета в раствор — очищение от грязи и пыли, обезжиривание, промывание и высушивание.
Нанесение ортофосфорной кислоты кисточкой на поверхность предмета
На практике бывают такие примеры, когда площадь ржавого участка оказывается слишком большой В этом случае для очистки поверхности металла прибегают к помощи болгарки, иначе снять слой ржавчины у вас не получится. Работу надо производить достаточно аккуратно, чтобы на металле не образовались дырки. После тщательной очистки и полного высыхания кислоту наносят на поверхность и оставляют на 2 часа, а потом смывают и просушивают.
Ортофосфорная кислота является очень эффективным средством для удаления ржавчины на поверхности металла, но, пользуясь ею, необходимо соблюдать некоторые правила, которые уберегут вас от неприятных последствий при ее применении.
1. Предварительная очистка металла должна проводиться с осторожностью, иначе металл может истончиться.
2. «Здоровую» поверхность металла необходимо накрыть защитной пленкой, нанося кислоту только на участки, пораженные ржавчиной.
3. Не применять кислоту на акриловой поверхности.
4. При обработке металла кислотой необходимо пользоваться защитной одеждой, обувью, перчатками и специальным очками.
5. Не игнорируйте ни один этап работы, иначе не достигните желаемого результата.
Ортофосфорную кислоту нужно не только правильно использовать, но и соблюдать условия ее хранения и транспортировки. Емкости для хранения ортофосфорной кислоты должны быть тщательно вымыты и просушены. Перевозить кислоту допускается только в закрытом виде, т.к. она является веществом с агрессивными составляющими. Смотрим видео.
Не допускайте попадания в емкость с кислотой каких либо посторонних предметов, иначе все ваши усилия по очистке металла от ржавчины окажутся напрасными. Продается ортофосфорная кислота от ржавчины в отделах промышленной химии, хранится в бутылках, канистрах и в других закрытых емкостях. Срок годности товара составляет 6 месяцев.
Продается ортофосфорная кислота от ржавчины в отделах промышленной химии, хранится в бутылках, канистрах и в других закрытых емкостях. Срок годности товара составляет 6 месяцев.
Читайте также:
Ортофосфорная кислота — Госстандарт
Формула ортофосфорной кислоты: — H3PO4. Приставка «орто» указывает на то, что кислота кислородная и, что в ней содержится наибольшее число гидроксильных групп.
Меньше всего их в мета-соединениях. Среднее число – в пара — кислотах. У фосфорной есть и мета-, и пара-изомер. Заметим, что все три приставки используют, так же, в названиях органических кислот, к коим ортофосфорная не относится. В органической химии, мета – характеристика для заместителей структурного кольца, стоящих через один атом. В пара-соединениях заместители максимально удалены, а в орто – соседи.
Внешне ортофосфорная кислота – кристаллы ромбической формы. Они бесцветны и плавятся при 42 градусах Цельсия. Однако, из-за хорошей растворимости вещества в воде, химики чаще имеют дело с полугидратомкислоты. Его формула: — H3PO4*0,5 H2O.
Однако, из-за хорошей растворимости вещества в воде, химики чаще имеют дело с полугидратомкислоты. Его формула: — H3PO4*0,5 H2O.
Если кристаллизовать полугидрат, получатся гексагональные призмы. Увидеть их можно, взяв раствор ортофосфорной кислоты и охладив его. Выпадет осадок. Это и есть полугидрат. Его температура плавления на 13 градусов меньше, чем у чистой кислоты. С водой кислота смешивается в любых соотношениях. Причина кроется в системе связей с жидкостью. Молекулы кислоты охотно стыкуются с ней, отсоединяясь, при этом, друг от друга. То есть, в воде соединение распадается на массу отдельных фрагментов, создавших водородные связи со структурными элементами жидкости.
Если же рассматривать строение чистой ортофосфорной кислоты, то она представляет макромолекулу. Отдельные молекулы в ней связаны между собой. Водородные связи прочны и надежны. Это сказывается на физических свойствах.
Монолит плохо проводит электричество, почти не способен к диффузии, то есть, проникновению в другие вещества.
Если чистая ортофосфорная кислота плавится, то жидкость получается вязкой и маслянистой, — молекулы соединения не хотят отпускать друг друга. В растворе кислота может быть электролитом средней силы. Дойти до высшей отметки не дает внутреннее строение молекул ортофосфорного соединения. Длины связей между атомами в нем нетипичны. Согласно формуле, между фосфором и кислородом образуется двойная стыковка. Но, высчитывая длину связи, получаем 1,74, то есть, число, не кратное двум. Длина одинарной связи между кислородом и водородом, напротив, больше положенного, — 1,3 вместо 1-го. Получается, электронная плотность связи P=O частично распределяется по другим связям.
Отсутствие резкого различия в длинах связей приводит к нестандартному строению молекул. Их форма приближена к тетраэдрам, то есть, пирамидальна. Вследствие такого строения реакция ортофосфорной кислоты с большинством веществ невозможна, протекает медленно.
В химическом плане кислота пассивна, в отличии от серной и соляной кислот, с резким различием в длинах внутримолекулярных связей.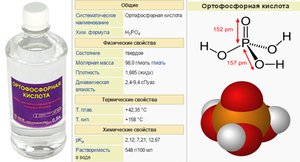
Из возможных химических реакций, определяющей для ортофосфорного соединения является взаимодействие с нитратом серебра. Выпадает желтый осадок
Добыча ортофосфорной кислоты
Ортофосфорную кислоту получают из фосфатов. Это эфиры и соли фосфорных кислот. Иногда используют ортофосфат калия с формулой K3PO4. но, чаще, берут конденсированные фосфаты. В них больше одного атома фосфора. Фосфаты, в свою очередь, добывают из фосфоритов. Это природное сырье, а точнее, группа минералов. Используют наиболее распространенные. Их два. Один – апатит, а второй фосфорит, в честь которого и названа группа камней.
Пример получения кислоты из соединении фосфата кальция и сульфата водорода. Запись реакции такова: — Ca3(PO4)2 + 3H2SO4 à 3CaSO4 + 2H3PO4.
Кроме фосфатов, в ход идет и пентохлорид фосфора. Его, так же, называют хлорангидридом фосфорной кислоты.
Для получения последней, достаточно гидролиза, то есть, взаимодействия с водой. Реакция такова: — PCL5 + 4H2O à H3PO4 + 5HCl.
Взаимодействовать с водой заставляют, так же, оксид фосфора. Его получают, сжигая 15-ый элемент в присутствии кислорода.
Взаимодействие оксида с водой дает две молекулы орто-кислоты, а значит, эта реакция наиболее выгодна, не имеет побочных продуктов. Убедимся, глядя на химическую запись процесса: — P2O5 + 3H2O à 2H3PO4.
Отметим, что с водой оксид фосфора реагирует бурно. Дабы слегка «усмирить» выброс тепла, бурление, исходное сырье обрабатывают концентрированным раствором уже полученной кислоты. Концентрат необходимо нагреть до 200-от градусов Цельсия.
Применение ортофосфорной кислоты
Удаление ортофосфорной кислоты из жизни человека может вызвать коллапс. Соединение используется, как минимум, в семи сферах промышленности.
В пищевой отрасли кислоту называют Е338. Обработка ортофосфорной кислотой продуктов фиксирует их цвет, не позволяет изменить его. Во многом, это вызвано тем, что добавка приостанавливает процессы окисления.
Е338 относится к антиоксидантам, в отличие от многих ешек, полезна, как и сам фосфор. В организме он входит в фосфотазы.
Это ферменты, без коих клетки не смогут нормально функционировать. Нормальный вкус без Е338 тоже получается не всегда.
Добавка придает блюдам приятные кислинку, или остроту. Конкретный вкус зависит от количества кислоты в продукте и ее концентрации.
Ортофосфорная кислота с металлами реагирует, как и большинство кислот.
Именно поэтому, за длительный срок, соединение может растворить гвоздь и, именно поэтому, используется в очищающих смесях для снятия ржавчины, полировки металлических поверхностей.
Ортофосфорная кислота от ржавчины чаще всего используется в быту, при реставрации предметов.
При этом, реагент используют и на крупном производстве. Металлурги делают на основе ортофосфорного соединения флюсы.
Они облегчают отделение от руды пустой породы и снижают температуру плавления. Соответственно, флюсы нужны при пайке.
Ортофосфорная кислота в аптеке. Вещество входит в состав средств от мочекаменной болезни.
К тому же, героиню статьи используют стоматологи. Им реактив нужен для протравки эмали перед пломбированием, а так же, обработки внутренней части коронок.
Кислота частично растворяет металлическую основу протезов. В ней появляются поры, в которые попадает скрепляющий цемент. В итоге, соединение коронки с зубом получается максимально прочным.
Ортофосфорная кислота входит в состав фреонов, а они, как известно, — основа морозильных установок.
Основой героиня статьи является и для многих косметических средств. В них кислота стабилизирует химические связи между составными элементами.
Аналогичную функцию соединение выполняет в моющих средствах из разряда бытовой химии.
Добавим к списку ортофосфорную кислоту в гидрожидкостях для авиационной технике, в удобрениях, даже в молекулярных исследованиях биологов. Последние, используют реагент для осветления срезов тканей, рассматриваемых под микроскопом.
Цена ортофосфорной кислоты
Купить ортофосфорную кислоту, как правило, предлагают в растворах. Основная концентрация – 85%. Разливают в канистры по 25,30, 32, 40 литров.
Стоит учесть, что стоимость зависит от ГОСТа. Ортофосфорная кислота 6552-80 чистая, подходит для пищевой промышленности, реактивов, косметической отрасли.
Но, есть и техническая жидкость. Она желтовата, что указывает на наличие загрязнений. ГОСТ технической кислоты – 10678-76. В рознице ортофосфорную кислоту продают в маленьких тюбиках.
Остальная продукция содержит много дополнительных элементов. В сельскохозяйственных удобрениях, к примеру, кроме ортофосфорной кислоты присутствует комплекс других минералов.
Поэтому, об объективной стоимости ортофосфорного соединения судят лишь по объявлениям об оптовых закупках концентрированного раствора реагента.
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Медицинская сфера, особенно стоматология, ортофосфорную кислоту применяет в своих целях: для борьбы с мочекаменной болезнью, как реактив для обработки внутренней поверхностей зубных коронок перед их установкой. Общеупотребительные названия: кислота фосфорная, о-фосфорная кислота, orthophosphoric acid, orthophosphoric acid, Е338
|
E338 — Фосфорная кислота
Добавка: E338 — Фосфорная кислота
Функции : Антиоксидант, секвестрант
Фосфорная кислота, также известная как ортофосфорная кислота или фосфорная кислота, представляет собой слабую кислоту с химической формулой h4PO4. Ортофосфорная кислота относится к фосфорной кислоте, которая является названием этого соединения по ИЮПАК. Приставка орто- используется для отличия кислоты от родственных фосфорных кислот, называемых полифосфорными кислотами. Ортофосфорная кислота — это нетоксичная кислота, которая в чистом виде является твердым веществом при комнатной температуре и давлении.Основание конъюгата фосфорной кислоты представляет собой ион дигидрофосфата, h3PO-4, который, в свою очередь, имеет сопряженное основание гидрофосфата, HPO2-4, которое имеет конъюгированное основание фосфата, PO3-4. Фосфаты необходимы для жизни. Самый распространенный источник фосфорной кислоты — это 85% водный раствор; такие растворы не имеют цвета, запаха и нелетучие. 85% раствор представляет собой сиропообразную жидкость, но все же текучий. Хотя фосфорная кислота не соответствует строгому определению сильной кислоты, 85% раствор достаточно кислый, чтобы вызывать коррозию.Из-за высокого процентного содержания фосфорной кислоты в этом реагенте по крайней мере часть ортофосфорной кислоты конденсируется в полифосфорные кислоты; ради маркировки и простоты 85% представляет h4PO4, как если бы он был в орто-форме. Разбавленные водные растворы фосфорной кислоты существуют в орто-форме.
Ортофосфорная кислота — это нетоксичная кислота, которая в чистом виде является твердым веществом при комнатной температуре и давлении.Основание конъюгата фосфорной кислоты представляет собой ион дигидрофосфата, h3PO-4, который, в свою очередь, имеет сопряженное основание гидрофосфата, HPO2-4, которое имеет конъюгированное основание фосфата, PO3-4. Фосфаты необходимы для жизни. Самый распространенный источник фосфорной кислоты — это 85% водный раствор; такие растворы не имеют цвета, запаха и нелетучие. 85% раствор представляет собой сиропообразную жидкость, но все же текучий. Хотя фосфорная кислота не соответствует строгому определению сильной кислоты, 85% раствор достаточно кислый, чтобы вызывать коррозию.Из-за высокого процентного содержания фосфорной кислоты в этом реагенте по крайней мере часть ортофосфорной кислоты конденсируется в полифосфорные кислоты; ради маркировки и простоты 85% представляет h4PO4, как если бы он был в орто-форме. Разбавленные водные растворы фосфорной кислоты существуют в орто-форме. — Википедия
— Википедия
Риск передозировки
Оценка EFSA : Повторная оценка фосфорной кислоты-фосфатов — ди-, три- и полифосфатов -E 338–341, E 343, E 450–452- в качестве пищевых добавок и безопасности предлагаемого расширения использования (2019 / 12.06)
Европейское управление по безопасности пищевых продуктов (EFSA) определило, что некоторые группы населения имеют высокий риск употребления слишком большого количества E338 — фосфорной кислоты.
Чтобы оценить свое воздействие на пищевую добавку E338 — фосфорная кислота, вы можете просмотреть наш список продуктов, которые ее содержат. См. Список продуктов с E338 — фосфорная кислота ниже.
: Риск превышения допустимой суточной дозы (ДСП)
Наименования: Ортофосфорная кислота, фосфорная кислота, Sels de l’acide phosphorique, калий-де-E338, фосфат д’гидроген, Acide monophosphorique
Ортофосфорная кислота, 131 — Большая химическая энциклопедия
Представлено Абтуром Г. Вебер Дж. И Дж. Б. Кинг, проверено Лоуренсом Л. Кттиллом и Уилфордом Х. Томасом [Pg.101]
Вебер Дж. И Дж. Б. Кинг, проверено Лоуренсом Л. Кттиллом и Уилфордом Х. Томасом [Pg.101]Ортофосфорная кислота высокой степени чистоты может быть получена путем кристаллизации кислоты из концентрированных растворов. Эти растворы получают путем удаления воды из обычной сиропообразной фосфорной кислоты при низкой температуре и давлении. Эту концентрацию необходимо выполнять с осторожностью, так как неполное удаление воды приводит к тому, что [Pg.101]
поместите 5 фунтов 85-процентной коммерческой сиропообразной ортофосфорной кислоты в 5-1., круглодонная колба, оборудованная конденсатором и колбой для всасывания и размещенная, как показано на рис. 17, таким образом, что воздух осушается, проводя его [Стр.101]
Для кристаллизации концентрированного остатка затравку с кристаллом кислота, полученная путем переохлаждения части концентрированной кислоты на ледяной бане. Температура должна поддерживаться на уровне около 30 ° C. на протяжении всей кристаллизации. [Стр.102]
После того, как примерно одна треть материала кристаллизовалась, слейте маточный раствор с кристаллов в безводной атмосфере. Чтобы получить очень сухую кислоту, необходима перекристаллизация. Высушите твердую кислоту, пропустив через кристаллы очень сухой воздух при низком давлении в течение нескольких дней. [Стр.102]
Чтобы получить очень сухую кислоту, необходима перекристаллизация. Высушите твердую кислоту, пропустив через кристаллы очень сухой воздух при низком давлении в течение нескольких дней. [Стр.102]
Фосфорная кислота. Коммерческая сиропообразная ортофосфорная кислота имеет пр. гр. 1-75 и содержит около 88 процентов h4PO4. Также продается около 100% кислоты. [Стр.189]
В 500 мл. Трехгорлая колба, снабженная термометром, герметичной мешалкой Хершберга и обратным холодильником, вместимостью 32-5 г. оксида фосфора и добавить 115-5 г.(67-5 мл.) 85% ортофосфорной кислоты (1). Когда перемешиваемая смесь остынет до комнатной температуры, ввести 166 г. йодида калия и 22-5 г. бидистиллированного 1,4-бутандиола (т.кип. 228-230 ° или 133-135 ° / 18 мм.). Смесь нагревают при перемешивании при 100-120 ° в течение 4 часов. Охлаждают перемешиваемую смесь до комнатной температуры и добавляют 75 мл. воды и 125 мл. эфира. Отделить эфирный слой, обесцветить его встряхиванием с 25 мл. 10%, раствор тиосульфата натрия, промыть 100 мл.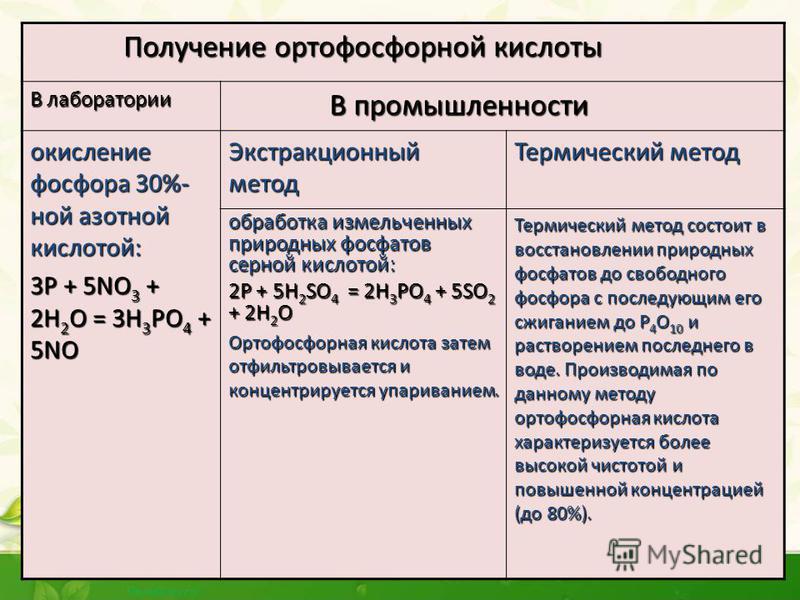 холодного насыщенного раствора хлорида натрия и сушат безводным сульфатом магния. Удалите эфир мгновенной перегонкой (разделы 11, 13, сравните рис. II, 13, 4) на паровой бане и перегоните остаток из колбы Клейзена с фракционирующим боковым плечом при пониженном давлении. Собирают 14-дииодбутан при 110 ° / 6 мм. выход 65 г. [Pg.284]
холодного насыщенного раствора хлорида натрия и сушат безводным сульфатом магния. Удалите эфир мгновенной перегонкой (разделы 11, 13, сравните рис. II, 13, 4) на паровой бане и перегоните остаток из колбы Клейзена с фракционирующим боковым плечом при пониженном давлении. Собирают 14-дииодбутан при 110 ° / 6 мм. выход 65 г. [Pg.284]
Ацетилтиофен Получают ацетилированием тиофена уксусным ангидридом в присутствии ортофосфорной кислоты … [Pg.837]
Растворимость в сиропообразной фосфорной кислоте.Этот тест следует проводить, только если соединение растворимо в концентрированной серной кислоте. Налейте 3 0 мл. 85% ортофосфорной кислоты в сухую пробирку и добавить 0 10 г. твердого вещества или 0-20 мл. жидкости. Если соединение не растворяется сразу, взболтать некоторое время, но не кипятить. [Стр.1056]
Ортофосфорная кислота h4PO4 (или селенистая кислота h3Se03 … [Стр.221]
Фильтровальная кислота дигидратного процесса содержит 28–32% P2 5, обычно концентрированная до 40–45% P2 s при использовании в участок по производству удобрений. Для транспортировки кислота концентрируется до 52—54% P2 5, при этих концентрациях продукт представляет собой ортофосфорную кислоту [7664-38-2] … [Pg.225]
Для транспортировки кислота концентрируется до 52—54% P2 5, при этих концентрациях продукт представляет собой ортофосфорную кислоту [7664-38-2] … [Pg.225]
| Рис. 25. Процесс производства трубчатого реактора TVA базовых суспензий 9-32-0 и 12-36-0 непосредственно из ортофосфорной кислоты мокрого производства. |
Сгущенное молоко — это жидкий продукт, полученный путем частичного удаления воды только из молока. Он имеет минимальное содержание жира в молоке 7.5 мол.% И минимальное содержание сухих веществ молока 25,0 мол.%. Сгущенное обезжиренное молоко — это продукт Hquid, получаемый путем частичного удаления воды только из обезжиренного молока. Он имеет минимальное содержание сухих веществ молока 20,0% мол. Сгущенное молоко с сахаром — это продукт, полученный путем частичного удаления воды из молока только с добавлением сахаров. Он имеет минимальное содержание молочного жира 8,0 мол.% И минимальное содержание сухих веществ молока 28,0 мол.%. Сгущенное молоко обезжиренное с сахаром — это продукт, полученный путем частичного удаления воды только из обезжиренного молока с добавлением сахаров.Он имеет минимальное содержание сухих веществ молока 24,0% мол. AH может содержать пищевые добавки (qv) в качестве стабилизаторов в максимальных количествах, включая натриевые, калиевые и кальциевые соли соляной кислоты в концентрации 2000 мг / кг, отдельно лимонной кислоты, угольной кислоты, ортофосфорной кислоты и полифосфорной кислоты в концентрации 3000 мг / кг в комбинация, выраженная в виде безводных веществ, и каррагенин сгущенного молока может быть добавлен в количестве 150 мг / кг.
Он имеет минимальное содержание жира в молоке 7.5 мол.% И минимальное содержание сухих веществ молока 25,0 мол.%. Сгущенное обезжиренное молоко — это продукт Hquid, получаемый путем частичного удаления воды только из обезжиренного молока. Он имеет минимальное содержание сухих веществ молока 20,0% мол. Сгущенное молоко с сахаром — это продукт, полученный путем частичного удаления воды из молока только с добавлением сахаров. Он имеет минимальное содержание молочного жира 8,0 мол.% И минимальное содержание сухих веществ молока 28,0 мол.%. Сгущенное молоко обезжиренное с сахаром — это продукт, полученный путем частичного удаления воды только из обезжиренного молока с добавлением сахаров.Он имеет минимальное содержание сухих веществ молока 24,0% мол. AH может содержать пищевые добавки (qv) в качестве стабилизаторов в максимальных количествах, включая натриевые, калиевые и кальциевые соли соляной кислоты в концентрации 2000 мг / кг, отдельно лимонной кислоты, угольной кислоты, ортофосфорной кислоты и полифосфорной кислоты в концентрации 3000 мг / кг в комбинация, выраженная в виде безводных веществ, и каррагенин сгущенного молока может быть добавлен в количестве 150 мг / кг. [Pg.365]
[Pg.365]
| Рис. 1. Кривая титрования ортофосфорной кислоты в присутствии гидроксида натрия. |
 [Pg.328]
[Pg.328]Ортофосфатные соли обычно получают путем частичной или полной нейтрализации ортофосфорной кислоты.Диаграммы фазового равновесия особенно полезны для определения условий получения конкретных фосфатных солей. Свойства растворов ортофосфатных солей одновалентных катионов резко отличаются от свойств раствора поливалентных катионов, последние в большинстве случаев проявляют растворимость в растворе. Коммерческие фосфаты включают соли щелочных металлов, щелочноземельных металлов, тяжелых металлов, смешанных металлов и аммониевые соли фосфорной кислоты. Фосфаты натрия являются наиболее важными, за ними следуют соли кальция, аммония и калия.[Pg.331]
Гидролиз сульфидов фосфатов изучен количественно. Формируется ряд продуктов (таблица 6). В то время как сульфид фосфома (V) медленно реагирует с холодной водой, реакция протекает быстрее при нагревании с образованием в основном сероводорода и ортофосфорной кислоты h3PO4. При высоком pH P4S Q гидролизуется до смеси продуктов, содержащих тиофосфаты и сульфиды. [Стр.363]
[Стр.363]
H PO поэтому является более сильной кислотой, чем ортофосфорная кислота. Вторая константа диссоциации, pR 2> Th, третий водород не ионизируется… [Pg.373]
Эти предшественники получают реакцией дымящей азотной кислоты в избытке уксусного ангидрида при низких температурах с 2-фуранкарбоксальдегидом [98-01-1] (фурфурол) или его диацетатом (16) с последующей обработкой промежуточное соединение 2-ацетокси-2,5-дигидрофуран [63848-92-0] с пиридином (17). Этот процесс был улучшен за счет использования концентрированной азотной кислоты (18,19), а также каталитических количеств пентоксида, трихлорида и оксихлорида фосфома (20) и серной кислоты (21). Ортофосфорная кислота, -толуолсульфоновая кислота, мышьяковая кислота, борная кислота и стибоновая кислота, среди прочего, являются полезными добавками для нитрования фурфурола ацетилнитратом.Гидролиз диацетата 5-нитро-2-фуранкарбоксиальдегида [92-55-7] водными минеральными кислотами дает альдегид, который подходит для использования без дополнительной очистки. [Pg.460]
[Pg.460]
Производство 2-ацетилтиофенов включает прямую реакцию тиофена или алкилтиофена с уксусным ангидридом или ацетилхлоридом. В предпочтительных системах используется уксусный ангидрид и в качестве катализаторов используются йод или ортофосфорная кислота. Первый катализатор упрощает обработку, но имеет недостаток, заключающийся в повышении уровня 3-изомера в продукте.Процессы, требующие очень низких уровней 3-изомера, работают с катализаторами, которые являются патентованными, хотя уровни менее 0,5% не легко достигаются. [Стр.21]
h2C фосфат ортофосфорная кислота (AP + и Zn «+) кальцинированный оксид 2инк, кальцинированный оксид магния оксиды фосфатный фиксатор, основание … [Стр.472]
Смесь 85% ортофосфорной кислоты (4 части ) и метафосфорная кислота (1 часть) … [Pg.35]
Фосфор существует в виде белого и красного фосфора.Первый аллотроп может храниться в темноте при низких температурах, но в остальном превращается в более устойчивую красную форму. Белая форма представляет собой воскообразное, полупрозрачное, кристаллическое, высокотоксичное твердое вещество, возгоняющееся при комнатной температуре и воспламеняющееся на воздухе при 35 ° C, поэтому с ним обращаются под водой. Красная форма представляет собой красновато-фиолетовое кристаллическое твердое вещество, которое испаряется при нагревании при атмосферном давлении и конденсируется с образованием белого фосфора. Красная форма воспламеняется на воздухе при температуре 260 ° C. Оба они нерастворимы в воде, а белый фосфор может накапливаться под ней. Фосфор образует множество соединений, таких как фосфин, три- и пентагалогениды, три-, тетра- и пентаоксиды, оксикислоты, включая гипофосфористую, ортофосфорную и ортофосфорную кислоты.[Стр.31]
Белая форма представляет собой воскообразное, полупрозрачное, кристаллическое, высокотоксичное твердое вещество, возгоняющееся при комнатной температуре и воспламеняющееся на воздухе при 35 ° C, поэтому с ним обращаются под водой. Красная форма представляет собой красновато-фиолетовое кристаллическое твердое вещество, которое испаряется при нагревании при атмосферном давлении и конденсируется с образованием белого фосфора. Красная форма воспламеняется на воздухе при температуре 260 ° C. Оба они нерастворимы в воде, а белый фосфор может накапливаться под ней. Фосфор образует множество соединений, таких как фосфин, три- и пентагалогениды, три-, тетра- и пентаоксиды, оксикислоты, включая гипофосфористую, ортофосфорную и ортофосфорную кислоты.[Стр.31]
Химические обозначения — синонимы Ортофосфорная кислота Химическая формула h4PO4. [Pg.314]
Раствор для распыления Для сахаров [3] растворите 3 г 2-аминодифенила в 100 мл ледяной уксусной кислоты и добавьте 1,5 мл 85% ортофосфорной кислоты. [Стр.157]
[Стр.157]
Вещества Бифенил-2-иламин Серная кислота (25%) Этанол Ледяная уксусная кислота Ортофосфорная кислота (85%) … [Стр.157]
См. Другие страницы, где упоминается Ортофосфорная кислота, 131 : [Стр.309] [Pg.244] [Pg.243] [Pg.284] [Pg.284] [Pg.284] [Pg.540] [Pg.837] [Pg.707] [Pg.226] [Pg.238] [Pg.238] [Pg.239] [Pg.241] [Стр.159] [Pg.225] [Pg.366] [Pg.323] [Pg.324] [Pg.327] [Pg.472] [Стр.130] [Pg.401] [Pg.450] [Стр.154] [Pg.179]
См. Также в источнике #XX — [ Стр.314 ]
См. Также в источнике #XX — [ Стр.3 , Стр.145 ]
См. Также в источнике №XX — [ Стр.153 , Стр.180 , Стр.254 , Стр.317 , Стр. 328 , Стр.335 , Стр.365 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.581 ]
Также в источнике №XX — [ Стр.581 ]
См. Также в источнике №XX — [ Стр.947 , Стр.948 ]
См. Также в источнике №XX — [ Стр.386 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр. 331 ]
См. Также в источнике №XX — [ Стр.158 ]
См. Также в источнике №XX — [ Стр.410 , Стр.412 , Стр.413 ]
См. Также в источнике №XX — [ Стр.30 , Стр.43 ]
См. Также в источнике №XX — [ Стр.906 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.450 ]
См. Также в источнике №XX — [ Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.530 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр.848 ]
Также в источнике №XX — [ Стр.848 ]
См. Также в источнике №XX — [ Стр.396 ]
См. Также в источнике №XX — [ Стр.314 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.931 ]
См. Также в источнике №XX — [ Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.45 , Стр.300 ]
См. Также в источнике №XX — [ Стр. 330 ]
См. Также в источнике №XX — [ Стр.254 ]
См. Также в источнике №XX — [ Стр.231 ]
См. Также в источнике №XX — [ Стр.62 ]
См. Также в источнике №XX — [ Стр.3 , Стр.6 , Стр.81 , Стр.101 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр.19 ]
См. Также в источнике №XX — [ Стр.3 , Стр.145 ]
Также в источнике №XX — [ Стр.3 , Стр.145 ]
См. Также в источнике №XX — [ Стр.101 ]
См. Также в источнике №XX — [ Стр.19 , Стр.20 ]
См. Также в источнике №XX — [ Стр.951 ]
См. Также в источнике №XX — [ Стр.108 ]
См. Также в источнике №XX — [ Стр.3 , Стр.4 , Стр.127 ]
См. Также в источнике №XX — [ Стр.935 ]
См. Также в источнике №XX — [ Стр.145 ]
См. Также в источнике №XX — [ Стр.1076 ]
Ортофосфорная кислота — Краткий профиль
Раздел «Идентификация вещества» связывает информацию об идентификации вещества из всех баз данных, которые поддерживает ECHA.Идентификаторы веществ — если они доступны и не заявлены как конфиденциальные — отображаются в разделе «Идентификация вещества» Краткого профиля:
- Название / номер ЕС
- Название / номер IUPAC
- Номер CAS
- Номер индекса
- Молекулярная формула
- Smiles
- InChI
Кроме того, в этом разделе отображается информация о типе вещества, происхождении, количестве и типе зарегистрированных составов и других местах, где указано вещество.
Название / номер ЕС (Европейское сообщество)
Название и номер ЕС являются официальными идентификаторами веществ в Европейском союзе и могут быть найдены в реестре ЕС.
Реестр ЕС представляет собой комбинацию трех независимых европейских списков веществ из предыдущих нормативных документов ЕС по химическим веществам (EINECS, ELINCS и NLP-list). Более подробную информацию об инвентаризации EC можно найти здесь. Если веществу не присвоен номер EC, ECHA присвоит номер списка.Эти номера начинаются с 6, 7, 8 или 9.
Название / номер IUPAC
Название IUPAC основано на международной стандартной химической номенклатуре, установленной Международным союзом теоретической и прикладной химии (IUPAC).
Номенклатура IUPAC — это систематический способ обозначения химических веществ, как органических, так и неорганических. В номенклатуре ИЮПАК префиксы, суффиксы и инфиксы используются для описания типа и положения функциональных групп в веществе.
Если в зарегистрированных досье REACH доступно более одного имени IUPAC, все имена IUPAC отображаются в разделе «Другие имена» краткого профиля.
Дополнительную информацию о Международном союзе чистой и прикладной химии можно найти на официальном веб-сайте ИЮПАК.
Регистрационный номер CAS (Химическая реферативная служба)
Номер CAS — это цифровой идентификатор вещества, присвоенный Химической реферативной службой, подразделением Американского химического общества, веществам, зарегистрированным в базе данных реестра CAS. С веществом может быть связано более одного номера CAS. В этом случае сначала отображается предпочтительный номер CAS.Подробнее о CAS и реестре CAS можно найти здесь.
Номер индекса
Номер индекса — это идентификационный код, присвоенный веществам в Части 3 Приложения VI к Регламенту CLP ((EC) № 1272/2008). Каждому номеру индекса соответствует четкая классификация и маркировка.
Индексный номер для каждого вещества представлен в виде последовательности цифр типа ABC-RST-VW-Y. ABC соответствует порядковому номеру наиболее характерного элемента или наиболее характерной органической группы в молекуле.RST — порядковый номер вещества в ряду ABC. VW обозначает форму, в которой вещество производится или размещается на рынке. Y — это контрольная цифра, рассчитанная в соответствии с 10-значным методом ISBN.
ABC соответствует порядковому номеру наиболее характерного элемента или наиболее характерной органической группы в молекуле.RST — порядковый номер вещества в ряду ABC. VW обозначает форму, в которой вещество производится или размещается на рынке. Y — это контрольная цифра, рассчитанная в соответствии с 10-значным методом ISBN.
Молекулярная формула
Молекулярная формула идентифицирует каждый тип элемента по его химическому символу и определяет количество атомов каждого элемента в одной дискретной молекуле вещества. Если такая информация доступна в базе данных ECHA и не считается конфиденциальной, здесь будут отображаться молекулярная формула и молекулярная структура.
УЛЫБКИ
УЛЫБКИ — это аббревиатура от Simplified Molecular Input Line Entry Specification, химической системы обозначений, используемой для представления молекулярной структуры с помощью линейной строки символов.
В стандартных SMILES название молекулы является синонимом ее структуры: оно косвенно показывает двумерную картину молекулярной структуры. Поскольку двумерную химическую структуру можно нарисовать различными способами, существует несколько правильных обозначений SMILES для одной молекулы.
Поскольку двумерную химическую структуру можно нарисовать различными способами, существует несколько правильных обозначений SMILES для одной молекулы.
В основе SMILES лежит представление валентной модели молекулы. Обозначения SMILES состоят из атомов (обозначенных символами элементов), связей, скобок (используются для обозначения ветвления) и чисел (используются для циклических структур).
InChI
InChI — это сокращенное название Международного химического идентификатора IUPAC, химического идентификатора, разработанного и поддерживаемого InChI Trust.
InChI состоят из текстовых строк, содержащих различные слои и подслои информации, разделенные косой чертой (/).Каждая строка InChI начинается с номера версии InChI, за которым следует основной уровень. Этот основной слой содержит подслои для химической формулы, атомных связей и атомов водорода. В зависимости от структуры молекулы за основным слоем могут следовать дополнительные слои, например для заряда, стереохимической и / или изотопной информации.
Молекулярная структура
Молекулярная структура, отображаемая в этом разделе, основана на аннотации InChI из базы данных эталонных веществ IUCLID и хранится в базе данных ECHA.Структура — это компьютерная визуализация молекулярной структуры, полученная из строки символов InChI.
Тип вещества
Зарегистрированные лица могут идентифицировать свое вещество как однокомпонентное, многокомпонентное вещество, UVCB, полимер или указать другой тип. Если зарегистрировано более одного типа вещества, будут отображаться оба типа.
Происхождение
Зарегистрированные лица могут идентифицировать происхождение своего вещества как:
- Элемент
- Неорганическое
- Органическое
- Металлоорганическое
- Нефтепродукт
- Другое
Если зарегистрировано более одного типа вещества , будут отображаться оба типа.
Зарегистрированные композиции (добавки и примеси)
Здесь отображается общее количество неконфиденциальных зарегистрированных композиций, представленных в досье REACH. Если есть добавки и примеси, относящиеся к классификации веществ, они также указываются.
Если есть добавки и примеси, относящиеся к классификации веществ, они также указываются.
В контексте REACH примесей являются непреднамеренными составляющими, присутствующими в производимом веществе. Например, он может происходить из исходных материалов или быть результатом вторичных или неполных реакций в процессе производства.Хотя он присутствует в конечном веществе, он не был добавлен намеренно. В большинстве случаев примеси составляют менее 10% вещества.
Добавки — это компоненты, которые были намеренно добавлены в процессе производства для стабилизации вещества.
Вещество внесено в список
Предоставляет информацию, если вещество было идентифицировано одной из следующих предыдущих нормативных баз ЕС по химическим веществам:
- EINECS (Европейский перечень существующих коммерческих химических веществ), список
- ELINCS (Европейский список нотифицированных химических веществ) Вещества) Список
- Список NLP (больше не полимеров)
Ортофосфорная кислота — Информация о веществе
Раздел «Идентификация вещества» рассчитывается на основе идентификационной информации вещества из всех баз данных ECHA. Идентификаторы веществ, отображаемые в InfoCard, представляют собой наилучшее доступное название вещества, номер EC, номер CAS и / или молекулярные и структурные формулы.
Идентификаторы веществ, отображаемые в InfoCard, представляют собой наилучшее доступное название вещества, номер EC, номер CAS и / или молекулярные и структурные формулы.
Некоторые идентификаторы веществ могли быть заявлены как конфиденциальные или не были предоставлены, и поэтому не отображаться.
Номер ЕС (Европейское сообщество)
Номер ЕС — это числовой идентификатор веществ в реестре ЕС. Инвентаризация ЕС представляет собой комбинацию трех независимых европейских списков веществ из предыдущих нормативных документов ЕС по химическим веществам (EINECS, ELINCS и NLP-list).Более подробную информацию об инвентаризации EC можно найти здесь.
Если вещество не было охвачено реестром ЕС, ECHA присваивает номер списка в том же формате, начиная с цифр 6, 7, 8 или 9.
Номер EC или список является основным идентификатором вещества, используемым ECHA. .
Регистрационный номер CAS (Chemical Abstract Service)
Номер CAS — это цифровой идентификатор вещества, присвоенный Chemical Abstracts Service, подразделением Американского химического общества, веществам, зарегистрированным в базе данных реестра CAS. Вещество, идентифицированное в первую очередь номером EC или списком, может быть связано с более чем одним номером CAS или с номерами CAS, которые были удалены. Более подробную информацию о CAS и реестре CAS можно найти здесь.
Вещество, идентифицированное в первую очередь номером EC или списком, может быть связано с более чем одним номером CAS или с номерами CAS, которые были удалены. Более подробную информацию о CAS и реестре CAS можно найти здесь.
Молекулярная формула
Молекулярная формула идентифицирует каждый тип элемента по его химическому символу и определяет количество атомов каждого элемента в одной дискретной молекуле вещества. Эта информация отображается только в том случае, если вещество четко определено, его идентичность не заявлена как конфиденциальная и в базах данных ECHA имеется достаточно информации для алгоритмов ECHA для создания молекулярной структуры.
Молекулярная структура
Молекулярная структура основана на структурах, созданных на основе информации, доступной в базах данных ECHA. Если генерируется, строка InChI также будет сгенерирована и сделана доступной для поиска. Эта информация отображается только в том случае, если вещество четко определено, его идентичность не заявлена как конфиденциальная и в базах данных ECHA имеется достаточно информации для алгоритмов ECHA для создания молекулярной структуры.


 Ее пары при длительном воздействии раздражают слизистую носа, что приводит к носовому кровотечению и возбуждению атрофических процессов, в редких случаях это чревато изменением формулы крови и разрушением зубов! Однако это возможно только при работе с данным веществом в чистом виде. В бытовых условиях при контакте с продуктами питания, в состав которых входит данная добавка, такие последствия невозможны!
Ее пары при длительном воздействии раздражают слизистую носа, что приводит к носовому кровотечению и возбуждению атрофических процессов, в редких случаях это чревато изменением формулы крови и разрушением зубов! Однако это возможно только при работе с данным веществом в чистом виде. В бытовых условиях при контакте с продуктами питания, в состав которых входит данная добавка, такие последствия невозможны! Растворима в этаноле и других растворителях.
Растворима в этаноле и других растворителях.