Етилбензен — Вікіпедія
| Етилбензен | |
|---|---|
Структурна формула | Просторова модель |
| Назва за IUPAC | етилбензен[1] |
| Інші назви | етилбензол, фенілетан |
| Ідентифікатори | |
| Номер CAS | 100-41-4 |
| PubChem | 7500 |
| Номер EINECS | 202-849-4 |
| DrugBank | DB01722 |
| KEGG | C07111 |
| ChEBI | 16101 |
| RTECS | DA0700000 |
| SMILES | CCc1ccccc1 |
| InChI | 1/C8h20/c1-2-8-6-4-3-5-7-8/h4-7H,2h3,1h4 |
| Номер Бельштейна | 1901871 |
| Номер Гмеліна | 2990 |
| Властивості | |
| Молекулярна формула | C8H10 |
| Молярна маса | 106,165 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Запах | гас |
| Густина | 0,8626 г/моль |
| Тпл | -94,96 °C[2] |
| Ткип | 136,19 °C[2] |
| Розчинність (вода) | 0,161 г/л |
| Тиск насиченої пари | 9,998 мм рт. ст. ст. |
| Діелектрична проникність (ε) | 2,4463 |
| Показник заломлення (nD) | 1,4959 (20 °C) |
| В’язкість | 0,631 мПа·с |
| Дипольний момент | 0,59±0,05 Д |
| Термохімія | |
| Ст. ентальпія утворення Δ fH | -12,3 кДж/моль () 29,9 кДж/моль (газ) |
| Ст. ентропія S | 360,5 Дж/(моль·K) (газ) |
| Теплоємність, c | 183,2 Дж/(моль·K) () |
| Небезпеки | |
| ЛД50 | 3,5—4,7 г/кг (щурі, орально) 15 г/кг (дермально) |
| Температура спалаху | 21 °C |
| Температура самозаймання | 432 °C |
| Вибухові границі | 0,8—6,7% |
| Пов’язані речовини | |
| Пов’язані речовини | бензен, стирен, толуен |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Ети́лбензе́н (також ети́лбензо́л
 За звичайних умов є безбарвною, легкозаймистою леткою рідиною з характерним запахом, що нагадує гас.
За звичайних умов є безбарвною, легкозаймистою леткою рідиною з характерним запахом, що нагадує гас.Незначні кількості етилбензену спостерігаються у кам’яновугільній смолі та нафті.
Етилбензен є важливим прекурсором у нафтохімічному синтезі. 99 % етилбензену, що виробляється у світі, використовується для синтезу стирену (фенілетилену), котрий, у свою чергу, є сировиною для полістирену. Невелика кількість етилбензену використовується як розчинник та антидетонатор.
За звичайних умов етилбензен — безбарвна, прозора рідина із запахом гасу.
| 0 °C | 25 °C | 50 °C | 75 °C | 100 °C |
|---|---|---|---|---|
| 0,872 | 0,631 | 0,482 | 0,380 | 0,304 |
Він змішується із великою кількість органічних розічнників. Також утворює азеотропні суміші.
Майже увесь промислово отримуваний етилбензен синтезується шляхом алкілювання бензену етиленом. Протягом кількох десятиліть як каталізатор реакції застосовували кислоти Льюїса, наприклад, розчинений хлорид алюмінію:
Протягом кількох десятиліть як каталізатор реакції застосовували кислоти Льюїса, наприклад, розчинений хлорид алюмінію:
Попри те, що використання AlCl3 є доцільним з боку загальної вартості виробництва, нині стрімко зростають витрати на утилізацію утворюваних відходів. На додачу цього, синтез за цим метод призводить до незначного пошкодження реакторів і трубопроводів через корозію. У 1980-х роках замість хлориду алюмінію почали використовувати каталізатори на основі цеолітів.
Алкілювання кислотами Льюїса[ред. | ред. код]
Рідкофазний синтез етилбензену за участі хлориду алюмінію був запроваджений у 1930-х роках. Варіації цього методу запровадили на підприємствах BASF, Monsanto, Dow Chemical та інших.
Алкілювання бензену етиленом є вкрай екзотермічним процесом (ΔH=-114 кДж/моль)[5], у присутності AlCl3 реакція відбувається дуже швидко, із майже стехіометричним виходом етилбензену. Окрім хлориду алюмінію, також застосовувалися й інші кислоти Льюїса: AlBr3, FeCl3, ZrCl4, BF3. У випадку хлориду алюмінію, як промотори використовують хлороетан або хлороводень — ці галогеніди зменшують кількість AlCl3, необхідну для перебігу процесу.
У випадку хлориду алюмінію, як промотори використовують хлороетан або хлороводень — ці галогеніди зменшують кількість AlCl3, необхідну для перебігу процесу.
У процесі виробництва суміш рідкого бензену та розчиненого каталізатору безперервно подають у реактор і перемішують для досягнення рівномірного розподілу. Згодом до суміші впорскуються етилен і промотуючі добавки. Ступінь перетворення етилену сягає 100 %. Поширеним молярним співвідношенням етилен: бензен є 0,3—0,35. Якщо співвідношення зрушиться у напрямку збільшення, зросте ймовірність перебігу побічних реакцій — трансалкілювання та ізомерного перегрупування. Подальше алкілювання бензену веде до зворотнього утворення поліалкілбензенів, які, для мінімізації втрат у виробництві, повертають у реактор.
Типовою температурою для проведення синтезу є 130 °C. Її підвищення призводить до зменшення активності каталізатора та утворення поліалкілбензентів і неароматичних сполук. Значення тиску у реакційній системі підбираються для витримування реагентів у рідкій фазі.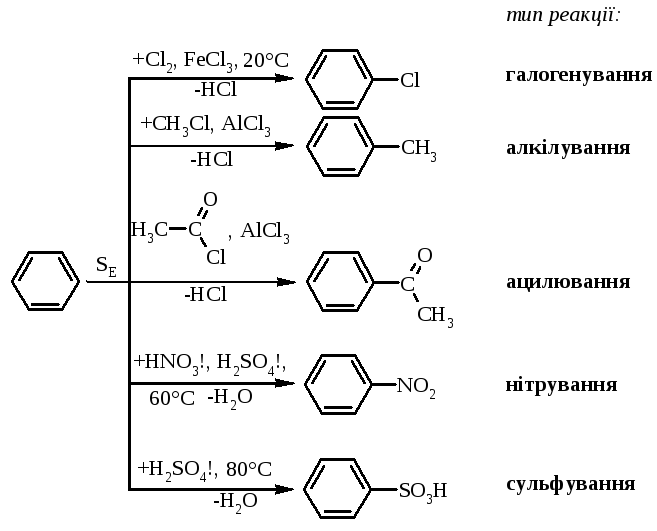 Іншим важливим моментом є наявність води у реакторі: окрім спричинення корозійних процесів, вона також суттєво знижує активність каталізатора, тому перед введенням бензену в реакцію проводиться його зневоднення.
Іншим важливим моментом є наявність води у реакторі: окрім спричинення корозійних процесів, вона також суттєво знижує активність каталізатора, тому перед введенням бензену в реакцію проводиться його зневоднення.
Після завершення взаємодії суміш продуктів і каталізатору, виводиться з реактору та охолоджується, а каталізатор відділяється з органічної фази декантацією й направляється на повторний цикл. Органічна фаза промивається водою та лугами для очищення її від залишків розчиненого хлориду алюмінію (утворена водна фаза, що містить розчинений AlCl
Очищення етилбензену зазвичай здійснюється у трьох дистиляційних колонах:
- у першій колоні відділяється легкокиплячий бензен, що не прореагував;
- у другій етилбензен відділяється від важчих поліалкілбензенів;
- у третій колоні із залишкових поліалкілбензенів з другої стадії відділяються сполуки, що піддаються переробці, від важких, переважно поліциклічних, які спалюються у вигляді палива.

Компанією Monsanto була запропонована модифікація методу, котра полягала у зменшенні кількості хлориду алюмінію до мінімально необхідного значення (що позитивно вплинуло на кількість утворюваних відходів) та підвищення температури в реакторі (до 160—180 °C). Ріст температури надає ще одну перевагу — можливість проведення синтезу за низького тиску етилену.
У 1960-х роках був запропонований метод із використанням флуориду бору, однак він не мав значного поширення через значний перебіг корозійних процесів. Попри це метод має суттєві переваги: продуктом виробництва є етилбензен високої чистоти, а як вихідну сировину можна використовувати неконцентрований етилен. Алкілювання проводиться за високого тиску (2,3—2,5 МПа) і низької температури (100—150 °C). Зневоднений бензен, етилен і BF3 подаються у реактор, із типовим молярним співвідношенням етилен: бензен близько 0,15—0,2. На відміну від першого процесу, тут трансалкілювання за участі сухого бензену, поліалкілбензенів та каталізатору проводиться в окремому реакторі, за вищої температури (180—230 °C).
Поєднані з обох реакторів продукти подаються на три дистиляційні колони, де першими відділяються бензен та інші легколеткі вуглеводні, BF3. Залишок від першої колони подається у другу, де відділяється етилбензен із чистотою >99,9 %. Кінцева колона слугує для виділення вуглеводнів, які піддаються переробці.
Метод може використовувати будь-яку етиленовмісну сировину, що містить принаймні 8—10 % етилену (сировину від переробки нафти, коксовий газ тощо). Однак, для такої сировини пред’являються особливі вимоги чистоти: вона не повинна містити води, сірчистих газів та киснемісних сполук, які отруюють каталізатор.
Алкілювання цеолітами[ред. | ред. код]
Перший метод алкілювання бензену в присутності цеолітів (алюмосилікатів) було розроблено 1970-х роках. Базовим каталізатором тоді був цеоліт ZSM-5.
Алкілювання проводиться у двох варіаціях: газофазній та рідкофазній.
Газофазний процес[ред. | ред. код]
Алкілювання проводиться за температури 350—450 °C і тиску 1—3 МПа.
Каталізатор поступово деактивується, перетворюючись на кокс, тому він потребує періодичного оновлення для регенерації. Регенерація in situ триває близько 36 годин і є необхідною після 18—24 місяців роботи каталізатору. Він є чутливим до дії води, сірковмісних сполук та інших каталітичних отрут.
Газуваті продукти реакції аналогічно до методу з кислотами Льюїса подаються на дистиляційні колони, до спершу виділяється бензен, згодом етилбензен, а від залишку алкіл- та поліалкілбензенів відділяють вуглеводні, котрі піддаються переробці. Решту важких вуглеводнів (переважно дифенілметан, дифенілетан) спалюють як паливо.
Рідкофазний процес[ред. | ред. код]
Впровадження рідкофазного алкілювання вперше відбулося у 1990 році на заводі однієї з дочірніх компаній Nippon Steel.
Взаємодія проводиться при температурах, що не перевищують критичне значення для бензену (239 °C). Корекція тиску в реакторі здійснюється таким чином, щоб усі легкі гази знаходилися у розчині (близько 4 МПа).
Продукти реакції розділяють на дистиляційних колонах: легкокиплячий бензен виділяється і повторно подається в реакційну систему, у другій колоні виділяється етилбензен, а решта (алкілбензени та поліетилбензени) подається на третю колону, де проходить розділення важких вуглеводнів, які частково повертаються на трансалкілювання.
Окрім бензену, основними домішками тут є неароматичні сполуки (нафтени), толуен, вищі алкілбензени.
Інші методи[ред. | ред. код]
Виділення з сумішей C8[ред. | ред. код]
Близько 1 % отримуваного етилбензену синтезують переробкою сировини при виробництві ксиленів. В основному виділення відбувається шляхом перегонки, котра, через складність її проведення, дістала назву суперфракціонування. Зростання вартость енергоносіїв не надало цьому методу вагомого поширениня.
Лабораторні методи[ред. | ред. код]
Етилбензен можна синтезувати за одним з варіантів реакції Вюрца:
- C6H5Br+C2H5Br+2Na⟶C6H5C2H5+2NaBr{\displaystyle \mathrm {C_{6}H_{5}Br+C_{2}H_{5}Br+2Na\longrightarrow C_{6}H_{5}C_{2}H_{5}+2NaBr} }
Ефективним є синтез за реакцією Корі — Хауса, котра відбувається у м’якших умовах і не супроводжується утворенням побічних продуктів
- C6H5Br+(C2H5)2CuLi→THF, 0oC C6H5C2H5+CuBr+LiBr{\displaystyle \mathrm {C_{6}H_{5}Br+(C_{2}H_{5})_{2}CuLi{\xrightarrow {THF,\ 0^{o}C}}\ C_{6}H_{5}C_{2}H_{5}+CuBr+LiBr} }
Також застосовується глибоке відновлення оксосполук (бензальдегіду, бензойної кислоти) за реакцією Кіжнера — Вольфа:
Найбільше значення з усіх властивостей етилбензену має дегідрогенізація, котра веде до утворення промислово важливого стирену:
Реакцію проводять за температури 600—660 °C у присутності каталізатору — оксиду заліза(III), промотованого калієм. До побічних реакцій відноситься деалкілювання з утворенням бензену або толуену.
До побічних реакцій відноситься деалкілювання з утворенням бензену або толуену.
У рідкій фазі етилбензен може окиснюватися повітрям із утворенням гідропероксиду. Однак вони є нестійким і при незначному підвищенні температури розкладається. Даний гідропероксид також є сировиною для отримання стирену (за участі пропілену):
Наявна у бензеновому кільці етильна група є орієнтантом першого роду, тому приєднання до кільця інших функціональних груп здійснюються у пара- та орто-положення, із переважанням першого:
- C6H5C2H5+Cl2→FeCl3 ClC6h5−C2H5+HCl{\displaystyle \mathrm {C_{6}H_{5}C_{2}H_{5}+Cl_{2}{\xrightarrow {FeCl_{3}}}\ ClC_{6}H_{4}{-}C_{2}H_{5}+HCl} }
- C6H5C2H5+h3SO4⟶HSO3−C6h5−C2H5+h3O{\displaystyle \mathrm {C_{6}H_{5}C_{2}H_{5}+H_{2}SO_{4}\longrightarrow HSO_{3}{-}C_{6}H_{4}{-}C_{2}H_{5}+H_{2}O} }
- C6H5C2H5+HNO3⟶O2N−C6h5−C2H5+h3O{\displaystyle \mathrm {C_{6}H_{5}C_{2}H_{5}+HNO_{3}\longrightarrow O_{2}N{-}C_{6}H_{4}{-}C_{2}H_{5}+H_{2}O} }
Окисненням етилбензену у присутності каталізатору ацетату марганцю отримують ацетофенон:
- C6H5C2H5+O2→130oC, Mn(OAc)2 C6H5C(O)Ch4+h3O{\displaystyle \mathrm {C_{6}H_{5}C_{2}H_{5}+O_{2}{\xrightarrow {130^{o}C,\ Mn(OAc)_{2}}}\ C_{6}H_{5}C(O)CH_{3}+H_{2}O} }
Етилбензен легко сорбується після вдихання, проковтування, а також при контакті зі шкірою. Його метаболізм, ймовірно, проходить через стадії окиснення у бічні ланцюги, про що свідчить наявність 2-фенілетанолу та 4-фенілетанолу у сечі уражених етилбензеном.[6]
Його метаболізм, ймовірно, проходить через стадії окиснення у бічні ланцюги, про що свідчить наявність 2-фенілетанолу та 4-фенілетанолу у сечі уражених етилбензеном.[6]
Короткотривала дія етилбензену може призводити до подразнення дихальних шляхів, болю в грудях, подразнення очей та запаморочення. Довготривала дія спричинює порушення нормального функціонування нирок і печінки, про що свідчать результати тестування на тваринах. Етилбензен не є канцерогеном. [7]
Абсолютна більшість отримуваного етилбензену використовується у виробництві стирену — промислово важливого мономеру для отримання полістирену. Незначна частка (менше 1 %) етилбензену застосовується у лакофарбовій промисловості як розчинник. Також він є вихідної сировиною для синтезу ацетофенону, діетилбензену, етилантрахінону. Етилбензен є антидетонаційною добавкою до моторного палива для збільшення його октанового числа.
- ↑ IUPAC Provisional Recommendations. — 2004. — P. 170. (англ.
 )
) - ↑ а б За тиску 101,3 кПа.
- ↑ CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- ↑ Lange’s Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- ↑ Оскільки реакція є сильноекзотермічною, деякі елементи реактору облицюють матеріалами з великою теплоємністю, на кшталт цегли.
- ↑ Welch, Vincent A., Fallon, Kevin J., Gelbke, Heinz-Peter. Ethylbenzene // Ullmann’s Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI:10.1002/14356007.a10_035.pub2. (англ.)
- ↑ Ethylbenzene. Hazard Summary. epa.gov. United States Environmental Protection Agency. квітень 1993. Процитовано 4 липня 2015. (англ.)
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005.
 — 2656 p. — ISBN 0-8493-0486-5. (англ.)
— 2656 p. — ISBN 0-8493-0486-5. (англ.) - Lange’s Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Welch, Vincent A., Fallon, Kevin J., Gelbke, Heinz-Peter. Ethylbenzene // Ullmann’s Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI:10.1002/14356007.a10_035.pub2. (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
- Химический энциклопедический словарь / Под ред. И. Л. Кнунянц. — : Сов. энциклопедия, 1983. — 792 с. (рос.)
Бензен — Вікіпедія
| Бензен | |
|---|---|
Структурна формула, запропонована Кекуле | Кульково-стриженева модель |
Формула скелету бензену | Просторова модель |
| Назва за IUPAC | Бензен |
| Інші назви | Бензол Циклогекса-1,3,5-трієн [6]-анулен |
| Ідентифікатори | |
| Номер CAS | 71-43-2 |
| PubChem | 241 |
| Номер EINECS | 200-753-7 |
| KEGG | C01407 |
| ChEBI | 16716 |
| RTECS | CY1400000 |
| SMILES | c1ccccc1 |
| InChI | 1/C6H6/c1-2-4-6-5-3-1/h2-6H |
| Номер Бельштейна | 969212 |
| Номер Гмеліна | 1671 |
| Властивості | |
| Молекулярна формула | C6H6 |
| Молярна маса | 78,11 г/моль |
| Зовнішній вигляд | Безбарвна рідина |
| Густина | 0,8765(20) г/см³ |
| Тпл | 5,5 °C, 278,7 K |
| Ткип | 80,1 °C, 353,3 K |
| Розчинність (вода) | 1,8 г/л (15 °C) [1] |
| Діелектрична проникність (ε) | 2,3 (за 25 °C) |
| Показник заломлення (nD) | 1,50112 |
| В’язкість | 0,652 Па•с за 20 °C |
| Дипольний момент | 0 Д |
| Небезпеки | |
| Класифікація ЄС | F T Канцероген категорії 1 Мутаген категорії 2 |
| NFPA 704 | 3 2 0 |
| Температура спалаху | −11,63 °C, 262 K |
| Температура самозаймання | 595 °C |
| Пов’язані речовини | |
| Пов’язані речовини | толуен етилбензен ксилени |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Бензе́н (також бензо́л) — перший представник гомологічного ряду ароматичних вуглеводнів, молекулярна формула C6H6. Безбарвна летка рідина з характерним запахом. Вперше отриманий Майклом Фарадеєм з конденсату піролізу китового жиру в 1825 році.
Безбарвна летка рідина з характерним запахом. Вперше отриманий Майклом Фарадеєм з конденсату піролізу китового жиру в 1825 році.
Промислово бензен добували із фракцій кам’яновугільної смоли, але з середини 20-го сторіччя практично весь промисловий об’єм бензену виробляється дегідрогенізацією нафтової сировини. Бензен має цінні властивості як розчинник, але через його високу токсичність і канцерогенність таке використання наразі дуже обмежено. Ця сполука є сировиною для промислового органічного синтезу, більше двох третин бензену іде на виробництво циклогексану, кумолу та етилбензену.
Бензен — перший із відкритих людиною аренів. У чистому вигляді він був виділений Майклом Фарадеєм шляхом дистиляції та кристалізації зі світного газу, що є продуктом високотемпературного розкладу китового жиру, і використовувався у вуличних ліхтарях . Тоді ж була встановлена відносна густина його пари та кількісне співвідношення між атомами елементів, що входять до його складу, на основі цих даних Фарадей обрахував емпіричну формулу — C2H2. Помилка у формулі була зроблена через те, що на той час вважалось, що атомна маса Карбону становить 6 а.о.м.. 1834 року Мітчерліх виділив бенезен шляхом сухої дистиляції бензойної кислоти із вапном, він встановив правильну емпіричну формулу (C6H6) і назвав цю сполуку «бензином» від бензойної кислоти[2] Проте Лібіх запропонував використовувати назву бензол, закінчення якої взяте зі слова нім. Öl — олія. Сучасна назва «бензен» рекомендується до використання IUPAC у зв’язку з тим, що суфікс -ол відповідає спиртам[3]. 1860 року Кекуле назвав бензен та інші сполуки з подібними властивостями ароматичними, через те, що більшість із них мали приємний запах.[4]
Помилка у формулі була зроблена через те, що на той час вважалось, що атомна маса Карбону становить 6 а.о.м.. 1834 року Мітчерліх виділив бенезен шляхом сухої дистиляції бензойної кислоти із вапном, він встановив правильну емпіричну формулу (C6H6) і назвав цю сполуку «бензином» від бензойної кислоти[2] Проте Лібіх запропонував використовувати назву бензол, закінчення якої взяте зі слова нім. Öl — олія. Сучасна назва «бензен» рекомендується до використання IUPAC у зв’язку з тим, що суфікс -ол відповідає спиртам[3]. 1860 року Кекуле назвав бензен та інші сполуки з подібними властивостями ароматичними, через те, що більшість із них мали приємний запах.[4]
| Історичні формули бензену, зліва направо: Клауса (1867), Дюара (1867), Ладенбурга (1869), Армстронга-Байєра (1887), Тіле (1899), Кекуле (1865) | |
| Формули Кекуле із публікації 1872 року | Формула Полінга |
.
На час встановлення правильної емпіричної формули бензену написання структурних формул органічних сполук ще не було прийнятим у хімії. Проте навіть після того, як для багатьох аліфатичних вуглеводнів були запропоновані структурні формули, для бензену це було зробити складніше: формула C6H6 свідчила про належність цієї сполуки до ненасичених вуглеводнів, проте бензен на відміну від алкенів та алкінів краще вступає в реакції заміщення ніж приєднання. У 1865 році Кекуле запропонував для бензену структурну формулу у вигляді шестичленного циклу з трьома подвійними зв’язками, що чергуються з одинарними. Широко відомими є твердження про те, що ідея циклічної структури бензену прийшла до Кекуле, коли йому наснився змій, що кусає себе за хвіст. У пізніших описах сну згадується про шістьох мавп, які тримають одна одну за задні лапи. Насправді циклічну структуру бенезну вперше опублікував у своїй книжці австрійський хімік Йозеф Лошмідт 1861 року і Кекуле бачив це видання[5].
Формули Кекуле не могли пояснити деяких особливостей бензену, наприклад того, що не існувало двох різних ізомерів 1,2-диметилбензену. 1872 року вчений опублікував статтю, в якій зазначав, що хоча для бензену можна припустити існування двох різних валентних ізомерів, реальна сполука є середнім між цими двома внаслідок осциляції (переходу) подвійних зв’язків[4][2]. Проте навіть таке доповнення не могло пояснити відмінність бензену від відомих ненасичених вуглеводнів, тому інші вчені продовжували пропонувати альтернативні варіанти структури цієї речовини. Серед них можна відзначити формули Дюара 1867 року та призматичну структуру Ладенбурга (1869). Зараз відомо, що такі сполуки справді можна синтезувати, вони є валентними ізомерами бензену[2].
Із пояснень властивостей бензену запропонованих до відкриття природи ковалентного зв’язку, найближчим до сучасного є теорія «парціальних валентностей» (від лат. partialis — частковий) запропонована Тіле 1899 року. Згідно з нею атоми Карбону в ненасичених сполуках мають часткові вільні валентності, які в молекулі бензену «замикаються» між собою, внаслідок чого різниця між одинарними і подвійними зв’язками зникає. Створення теорії ковалентного зв’язку дозволило краще зрозуміти структуру бенезену, 1926 року Інгольд зробив припущення, що в молекулі цієї сполуки електрони π-зв’язків зміщені до простих σ-зв’язків, внаслідок чого вони не існують в ізольованому стані, а вирівнюються між одинарними. Пізніше Лайнус Полінг виходячи із квантово-механічних уявлень, запропонував вважати, що в молекулі бензену відсутні окремі π-зв’язки, а всі їхні електрони об’єднані у суцільну π-хмару[4].
Згідно з нею атоми Карбону в ненасичених сполуках мають часткові вільні валентності, які в молекулі бензену «замикаються» між собою, внаслідок чого різниця між одинарними і подвійними зв’язками зникає. Створення теорії ковалентного зв’язку дозволило краще зрозуміти структуру бенезену, 1926 року Інгольд зробив припущення, що в молекулі цієї сполуки електрони π-зв’язків зміщені до простих σ-зв’язків, внаслідок чого вони не існують в ізольованому стані, а вирівнюються між одинарними. Пізніше Лайнус Полінг виходячи із квантово-механічних уявлень, запропонував вважати, що в молекулі бензену відсутні окремі π-зв’язки, а всі їхні електрони об’єднані у суцільну π-хмару[4].
У науковій літературі на позначення бензену використовують як формулу Полінга, так і формули Кекуле, хоча останні і не відображають структуру цієї молекули коректно.
Бензен — безбарвна рідина зі своєрідним запахом. Густина — 0.88 г/см³. За температури 80.1 °C кипить, а за 5.5 °C замерзає в білу кристалічну масу.
Бензен завдяки своїй симетричності є неполярною речовиною, тому не розчиняється у воді, проте утворює з нею азеотропну суміш (91.17 мас%) з температурою кипіння 69.25 °C. З більшістю неполярних розчинників змішується в будь-яких відношеннях, сам є добрим розчинником для багатьох органічних речовин.
В ультрафіолетовій ділянці спектру поглинання проявляється рядом смуг тонкої структури із відстанню між ними 5—6 нм (найінтенсивніше воно спостерігається в діапазоні 170–120 нм і менше в діапазоні — 270–240 нм).[4]
Делокалізація подвійних зв’язків у молекулі бензенуМолекулярна формула — C6H6. Рентгенографічними методами встановлено, що молекула бензену має форму плоского шестикутника з атомами Карбону у вершинах. Усі C—C зв’язки мають однакову довжину, що становить 0.140 нм. Це більше ніж у подвійного (0.134 нм) зв’язку і менше ніж в одинарного (0.154 нм) зв’язку. Бензен є неполярною сполукою з нульовим дипольним моментом (μ) [4].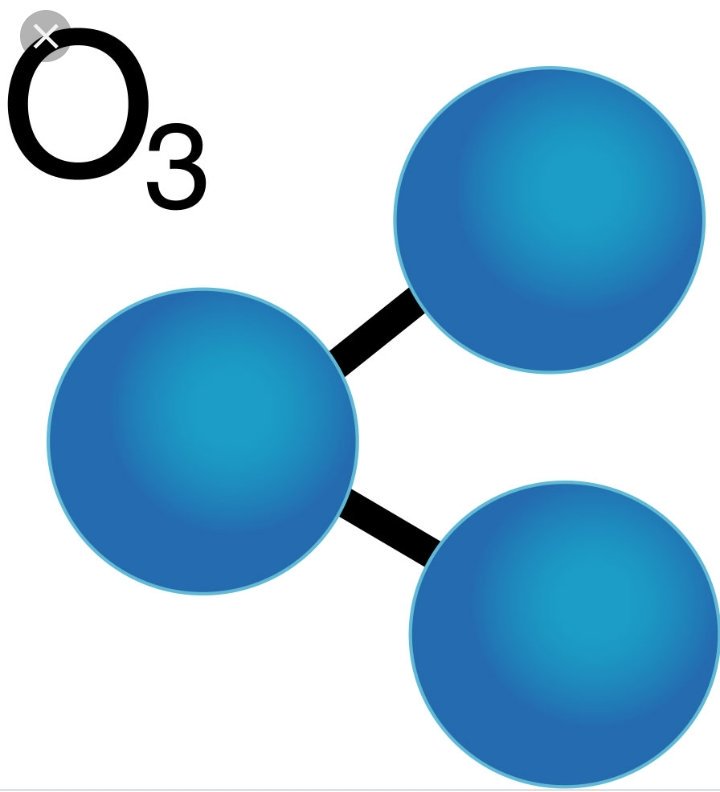
Всі атоми Карбону в молекулі бензену перебувають у стані sp2-гібридизації. Tри гібридні орбіталі розташовані під кутом 120°, утворюючи C—C та C—H σ-зв’язки. Hегібридні p-орбіталі розташовані перпендикулярно до площини молекули, утворюючи суцільне електронне кільце. З точки зору теорії валентних зв’язків це кільце можна розглядати як суперпозицію двох резонансних структур уявного 1,3,5-циклогексатрієну з ізольованими подвійними C=C зв’язками. З точки зору теорії молекулярних орбіталей його можна розглядати як результат делокалізації уздовж шести атомів Карбону трьох π-орбіталей подвійних C=C зв’язків. Наслідком делокалізації є менша вільна енергія (більша стабільність) бензену порівняно з 1,3,5-циклогексатрієном. Ця різниця в енергії називається енергією спряження, делокалізації або резонансу. Її можна обчислити спираючись на теплоти гідрування циклогексену та бензену:
- теплота гідрування ціклогексену становить 120 кДж/моль;
- тоді очікувана теплота гідрування 1,3,5-циклогексатрієну має становити близько 3×120 кДж/моль = 360 кДж/моль;
- насправді теплота гідрування бензену становить 208 кДж/моль;
- тоді енергія спряження становить 360 кДж/моль — 208 кДж/моль = 152 кДж/моль[4].

Утворення суцільної π-хмари, що містить шість електронів, надає молекулі бензену так званого ароматичного характеру. Карбоновий скелет молекули бензену з таким характером зв’язку називають бензеновим кільцем, або бензеновим ядром[4].
Внаслідок значної стійкості π-хмари для бензену, на відміну від неароматичних ненасичених вуглеводнів, найхарактерніші реакції заміщення, а не приєднання, оскільки вони мали б призводити до втрати ароматичності, проте реакції приєднання також можуть відбуватись за достатньо жорстких умов. Заміщення відбувається за електрофільним механізмом. Також бензен вступає в реакції окиснення.
Реакції електрофільного заміщення[ред. | ред. код]
Бензен вступає в реакції електрофільного заміщення, що відбуваються за таким механізмом: на першій стадії відбувається утворення π-комплексу між електрофілом (у формі катіону або сильно поляризованої молекули Eσ+-Nuσ−) та молекулою бензену, внаслідок перекривання НСМО електрофілу із ВЗМО (π-хмарою) бензену. Після цього пара p-електронів виходить із спряженого бензольного кільця і бере участь в утворенні σ-зв’язку із електрофілом, таким чином π-комплекс перетворюється у σ-комплекс або інтермедіат Уелланда. Ця проміжна сполука має позитивний заряд і позбавлена ароматичного характеру, через що є менш стійкою порівняно із ароматичним кільцем, в яке зазвичай швидко перетворюється внаслідок відщеплення протона (цей етап відбувається через ще один проміжний π-комплекс).[4]
Після цього пара p-електронів виходить із спряженого бензольного кільця і бере участь в утворенні σ-зв’язку із електрофілом, таким чином π-комплекс перетворюється у σ-комплекс або інтермедіат Уелланда. Ця проміжна сполука має позитивний заряд і позбавлена ароматичного характеру, через що є менш стійкою порівняно із ароматичним кільцем, в яке зазвичай швидко перетворюється внаслідок відщеплення протона (цей етап відбувається через ще один проміжний π-комплекс).[4]
Алкілювання та ацилювання за Фріделем-Крафтсом[ред. | ред. код]
Алкілювання бензену здійснюється алкілгалогенідами, алкенами та спиртами, ацилювання — карбоновими кислотами, галогенангідридами та ангідридами, обидва типи реакцій каталізуються кислотами Люїса. Ці реакції названо в честь їх першовідкривачів Шарля Фріделя та Джеймса Крафтса.
Роль каталізатора в цьому типі реакцій полягає у тому, що він взаємодіє із алкілюючим чи ацилюючим реагентом і забезпечує утворення карбкатіону або поляризованого комплексу. Наприклад при взаємодії хлорметану та алюміній хлориду утворюється комплекс із підсиленою електрофільністю атома карбону:
Наприклад при взаємодії хлорметану та алюміній хлориду утворюється комплекс із підсиленою електрофільністю атома карбону:
Прикладом реакції алкілювання може бути етилювання бензену хлоретаном.
Проте у промисловості етилбензен частіше отримують реакцією з етиленом, яка також проходить за присутності оксиду алюмінію, фосфатної або сульфатної кислоти:
Продуктами реакцій ацилювання бензену є ароматичні кетони. Прикладом може бути реакція із ацетилхлоридом, продуктом якої є метиларилкетон:
Галогенування[ред. | ред. код]
На відміну від ненасичених вуглеводнів бензен не знебарвлює бромну воду. Але для нього характерні реакції галогенування, що відбуваються за механізмом електрофільного заміщення, у присутності кислот Льюїса. Наприклад при взаємодії із бромом утворюється бромбензен:
Нітрування[ред. | ред. код]
Характерною для бензену є реакція нітрування для якої використовують нітруючу суміш, яка складається із концентрованої нітратної кислоти та концентрованої сульфатної кислоти як водовіднімаючого засобу. В цій реакції утворюється нітробензен, що є попередником у синтезі аніліну
В цій реакції утворюється нітробензен, що є попередником у синтезі аніліну
Сульфування[ред. | ред. код]
При дії на бензен концентрованої сульфатної кислоти відбувається його сульфування з утворенням бензосульфонової кислоти, що може бути попередником у синтезі фенолу:
Реакції приєднання[ред. | ред. код]
Бензен вступає і в реакції приєднання, але значно важче, ніж у реакції заміщення. При цьому він виявляє властивості ненасичених вуглеводнів. Так, у присутності нікелевого каталізатора і при нагріванні відбувається реакція гідрування бензену з утворенням циклогексану:
При цьому атоми Гідрогену приєднуються молекулою бензену за рахунок розриву подвійних зв’язків. Бензен вступає також у реакцію приєднання однієї, двох або трьох молекул хлору. Ця реакція відбувається за вільнорадикальним механізмом, для утворення радикалів хлору необхідне ультрафіолетове світло (досягається опроміненням ртутно-кварцовою лампою). Продуктом повного приєднання є гексахлорциклогексан:
Реакції окиснення[ред. | ред. код]
| ред. код]
На повітрі бензен горить сильно кіптявим полум’ям, оскільки вміст Карбону у ньому значний. Суміш пари бензену з повітрям вибухова. Завдяки ароматичному характеру бензен стійкий до дії окисників: не окиснюється розчином перманганату калію і нітратною кислотою. У присутності каталізатора ванадій(V) оксиду реагує із молекулярним киснем, внаслідок чого утворюється малеїновий ангідрид:
Також бензен окиснюється озоном, ця реакція історично використовувалась для встановлення його будови.
Одержання і виробництво[ред. | ред. код]
На сьогодні існує кілька принципово різних способів виробництва бензолу.
- Коксування кам’яного вугілля. Цей процес історично був першим та служив основним джерелом бензолу до Другої світової війни. Останнім часом частка бензолу, одержуваного цим способом, становить менше 10 %. Слід додати, що бензол, одержуваний з кам’яновугільної смоли, містить значну кількість тіофена, що робить такий бензол сировиною, непридатним для ряду технологічних процесів.

- Каталітичний риформінг (аромайзинг) бензинових фракцій нафти. Цей процес є основним джерелом бензолу в США. У Західній Європі, Росії та Японії цим способом отримують 40—60 % від загальної кількості сполуки. У цьому процесі крім бензолу утворюються толуол та ксилоли. З огляду на те, що толуол утворюється в кількостях, що перевищують попит на нього, його також частково переробляють в: бензол — методом гідродеалкілірування; суміш бензолу та ксилолів — методом диспропорціонування;
- Піроліз бензинових та більш важких нафтових фракцій. До 50 % бензолу виробляється цим методом. Поряд з бензолом утворюються толуол та ксилоли. У деяких випадках всю цю фракцію направляють на стадію деалкілірування, де і толуол, і ксилоли перетворюються на бензол.
- Тримеризація ацетилену.
- При пропусканні ацетилену при 600 °C над активованим вугіллям з хорошим виходом утворюється бензен та інші ароматичні вуглеводні (реакція М. Д. Зелінського):
- 3С2Н2 → С6H6,
- або
Бензен є важливою сировиною для хімічної промисловості. Великі кількості його йдуть для одержання нітробензену, який за реакцією М. М. Зініна відновлюють в анілін:
Великі кількості його йдуть для одержання нітробензену, який за реакцією М. М. Зініна відновлюють в анілін:
У техніці цю реакцію проводять при дії на бензен хлоридної кислоти в присутності залізних стружок. Залізо, реагуючи з кислотою, утворює водень, який у момент виділення відновлює нітробензен. З аніліну синтезують найрізноманітніші органічні барвники і фармацевтичні препарати. Значні кількості бензену використовують для синтезу фенолу, який йде на виробництво фенолформальдегідних смол. Гексахлороциклогексан, який одержують з бензену (реакція наведена вище), під назвою гексахлоран застосовується в сільському господарстві як один з найефективніших засобів для знищення комах. Крім того, бензен використовують для синтезу багатьох інших органічних сполук і як розчинник
| Отримання | Речовина | Застосування | ||
| + Cl2/AlCl3 → C6H5Cl | + Cl2/AlCl3 → 1,4-дихлорбензен | 1,4-дихлорбензен | Інсектицид | |
| + NaOH/Cu → Фенол | Фенол | Розчинник, реагент для органічного синтезу, пластмаси, барвники, ліки, вибухівка | ||
| + H2SO4 → Бензосульфонова кислота (C6H5-SO2OH) + NaOH → Фенол | ||||
| + Пропен (CH3-CH=CH2) → Кумен (C6H5-CH(CH3)2) + O2 → Гідроперокисид кумену (C6H5-C(CH3)2-OOH) → Фенол + Ацетон | ||||
| + HNO3 → Нітробензен + 6H→ Анілін | Анілін (C6H5-NH2) | Барвники, ліки | ||
| + H2/Ni → Циклогексан → Капролактам | Капролактам | Синтетичні волокна | ||
| + O2/V2O5 → Малеїнова кислота → Малеїновий ангідрид | Малеїновий ангідрид | Поліестери | ||
| + Етилен (CH2=CH2) → Етилбензен (C6H5-CH2-CH3) + ZnO → Стирен (C6H5-CH=CH2) + H2 | Стирен | Пластмаси, синтетичні каучуки | ||
| + HOSO2Cl → Бензосульфанілхлорид (C6H5-SO2Cl) → Бензосульфаніламід | Бензосульфаніламід | Ліки, барвники | ||
.
Нижче наведено процентне співвідношення використання
У суттєво менших кількостях бензол використовується для синтезу деяких інших сполук. Зрідка і в крайніх випадках, через високу токсичність, бензол використовується як розчинник. Крім того, бензол входить до складу бензину. Зважаючи на високу токсичності його зміст новими стандартами обмежена введенням до 5 %.
Основні хімічні товари та полімери, отримані з бензолу. Натиснувши на зображення завантажите відповідну статтюБензен, як і інші вуглеводні, утворює свій гомологічний ряд, що має загальну формулу CnH2n-6. Гомологи бензену можна розглядати як продукти заміщення одного або кількох атомів Гідрогену в молекулі бензену різними вуглеводневими радикалами, що утворюють бічні ланцюги.
Найпростішим гомологом бензену є метилбензен — продукт заміщення атома водню в молекулі бензену метильною групою — СН3
Метилбензен, що має технічну назву толуен, являє собою безбарвну рідину з характерним запахом. Температура кипіння 110,6 °C. Густина 0,867 г/см³
За своїми хімічними властивостями метилбензен, або толуен, як інші гомологи бензену, дуже близький до бензену. Так, при дії концентрованої нітратної кислоти, в присутності сульфатної кислоти він легко піддається нітруванню з утворенням тринітротолуену — сильно вибухової речовини
Температура кипіння 110,6 °C. Густина 0,867 г/см³
За своїми хімічними властивостями метилбензен, або толуен, як інші гомологи бензену, дуже близький до бензену. Так, при дії концентрованої нітратної кислоти, в присутності сульфатної кислоти він легко піддається нітруванню з утворенням тринітротолуену — сильно вибухової речовини
Метилбензен (толуен) добувають з кам’яновугільної смоли і коксового газу разом з бензеном, а потім відокремлюють шляхом дробної перегонки. Метилбензен, або толуен застосовують головним чином для виробництва вибухових речовин — тринітротолуену, який називають ще тротилом і толом. Крім того, толуен служить сировиною для виробництва барвників і інших органічних продуктів.
- ↑ Arnold D., Plank C., Erickson E., Pike F. (1958). Solubility of Benzene in Water. Industrial & Engineering Chemistry Chemical & Engineering Data Series 3 (2): 253. doi:10.1021/i460004a016.
Этилбензол — Ethylbenzene — qaz.wiki
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Этилбензол | |||
| Другие названия Этилбензол; Фенилэтан; альфа- метилтолуол; EB | |||
| Идентификаторы | |||
| 3D модель ( JSmol ) | |||
| Сокращения | EB | ||
| 1901871 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100,002,591 | ||
| КЕГГ | |||
| Номер RTECS | |||
| UNII | |||
| |||
| Свойства | |||
| С 8 Н 10 | |||
| Молярная масса | 106,168 г · моль -1 | ||
| вид | бесцветная жидкость | ||
| Запах | ароматный | ||
| Плотность | 0,8665 г / мл | ||
| Температура плавления | -95 ° С (-139 ° F, 178 К) | ||
| Точка кипения | 136 ° С (277 ° F, 409 К) | ||
| 0,015 г / 100 мл (20 ° С) | |||
| журнал P | 3,27 | ||
| Давление газа | 9,998 мм рт. | ||
| -77,20 · 10 −6 см 3 / моль | |||
| 1,495 | |||
| Вязкость | 0,669 сП в 20 ° C | ||
| 0,58 D | |||
| Термохимия | |||
| 1,726 Дж / (г · К) | |||
| Опасности | |||
| Основные опасности | Легковоспламеняющийся | ||
| Пиктограммы GHS | |||
| Сигнальное слово GHS | Опасность | ||
| h325 , h402 , h420 , h432 , h435 , h436 , h451 , h460 , h473 , h500 , h511 | |||
| «> Р201 , Р202 , Р210 , Р233 , Р240 , Р241 , P242 , P243 , P260 , P261 , P264 , «> P271 , P273 , P280 , P281 , P301 + 310 , P303 + 361 + 353 , Р304 + 312 , Р304 + 340 , Продолжайте полоскание.»> P305 + 351 + 338 , P308 + 313 , P312 , P314 , P331 , P337 + 313 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 22,22 ° С (72,00 ° F, 295,37 К) | ||
| 430 ° С (806 ° F, 703 К) | |||
| Пределы взрываемости | 1–7,8% | ||
| Смертельная доза или концентрация (LD, LC): | |||
| 5460 мг / кг | |||
| 4000 частей на миллион (крыса, 4 часа) | |||
| NIOSH (пределы воздействия на здоровье в США): | |||
| TWA 100 частей на миллион (435 мг / м 3 ) | |||
| REL (рекомендуется) | TWA 100 частей на миллион (435 мг / м 3 ) ST 125 частей на миллион (545 мг / м 3 ) | ||
| IDLH (Непосредственная опасность) | 800 частей на миллион | ||
| Родственные соединения | |||
| стирол , толуол | |||
Родственные соединения | бензол полистирол | ||
| Y проверить ( что есть ?) Y N | |||
| Ссылки на инфобоксы | |||
Этилбензол представляет собой органическое соединение с формулой C 6 H 5 CH 2 CH 3 . Это легковоспламеняющаяся бесцветная жидкость с запахом, похожим на запах бензина . Этот моноциклический ароматический углеводород важен в нефтехимической промышленности в качестве промежуточного продукта при производстве стирола , предшественника полистирола , обычного пластического материала. В 2012 году более 99% произведенного этилбензола было израсходовано на производство стирола.
Это легковоспламеняющаяся бесцветная жидкость с запахом, похожим на запах бензина . Этот моноциклический ароматический углеводород важен в нефтехимической промышленности в качестве промежуточного продукта при производстве стирола , предшественника полистирола , обычного пластического материала. В 2012 году более 99% произведенного этилбензола было израсходовано на производство стирола.
Возникновение и приложения
Этилбензол естественным образом содержится в каменноугольной смоле и нефти .
Основное применение этилбензола — роль промежуточного продукта в производстве полистирола. Каталитическое дегидрирование этилбензола дает водород и стирол :
- C
6 ЧАС
5 CH
2 CH
3 → С 6 Н 5 СН = СН 2 + Н
2
По состоянию на май 2012 г. для этой цели используется более 99% всего производимого этилбензола.
для этой цели используется более 99% всего производимого этилбензола.
Ниша использует
Этилбензол добавляется в бензин в качестве антидетонационного агента для уменьшения детонации двигателя и повышения октанового числа. Этилбензол часто содержится в других промышленных продуктах, включая пестициды , ацетат целлюлозы, синтетический каучук , краски и чернила. Используемый при добыче природного газа, этилбензол можно закачивать в землю.
Производство
Этилбензол производится в больших масштабах путем объединения бензола и этилена в химической реакции, катализируемой кислотой . В 1999 году было произведено около 24 700 000 тонн.
Промышленные методы
Этилбензол производится в больших масштабах путем объединения бензола и этилена в химической реакции, катализируемой кислотой :
- C
6 ЧАС
6 + C
2 ЧАС
4 → С
6 ЧАС
5 CH
2 CH
3
В 2012 году таким способом было произведено более 99% этилбензола. Таким образом, производители этилбензола являются основными покупателями бензола, на их долю приходится более половины от общего объема производства.
Таким образом, производители этилбензола являются основными покупателями бензола, на их долю приходится более половины от общего объема производства.
Небольшие количества этилбензола извлекаются из смеси ксилолов с помощью суперфракционирования, расширения процесса дистилляции .
В 1980-х годах процесс на основе цеолита с использованием парофазного алкилирования обеспечивал более высокую чистоту и выход. Затем был введен жидкофазный процесс с использованием цеолитных катализаторов . Это обеспечивает низкое соотношение бензола и этилена, уменьшая размер необходимого оборудования и уменьшая производство побочных продуктов.
Влияние на здоровье
Острая токсичность этилбензола низкая, LD 50 составляет около 4 граммов на килограмм веса тела. Долгосрочная токсичность и канцерогенность неоднозначны. Чувствительность глаз и горла может возникать при высоком уровне воздействия этилбензола в воздухе. При более высоком уровне воздействия этилбензол может вызвать головокружение. Попадая в организм, этилбензол биоразлагается до 1-фенилэтанола, ацетофенона , фенилглиоксиловой кислоты , миндальной кислоты , бензойной кислоты и гиппуровой кислоты . Воздействие этилбензола можно определить путем анализа продуктов распада в моче .
Попадая в организм, этилбензол биоразлагается до 1-фенилэтанола, ацетофенона , фенилглиоксиловой кислоты , миндальной кислоты , бензойной кислоты и гиппуровой кислоты . Воздействие этилбензола можно определить путем анализа продуктов распада в моче .
По состоянию на сентябрь 2007 года Агентство по охране окружающей среды США (EPA) определило, что питьевая вода с концентрацией 30 частей на миллион (ppm) в течение одного дня или 3 ppm в течение десяти дней, как ожидается, не окажет какого-либо неблагоприятного воздействия на детей. Ожидается, что воздействие 0,7 ppm этилбензола в течение всей жизни также не окажет отрицательного воздействия. Управление по безопасности и гигиене труда США (OSHA) ограничивает воздействие на рабочих в среднем 100 ppm в течение 8-часового рабочего дня или 40-часовой рабочей недели.
Этилбензол классифицируется Международным агентством по изучению рака (IARC) как возможный канцероген, однако EPA не определило этилбензол как канцероген. Национальная токсикологическая программа провела ингаляционное исследование на крысах и мышах. Воздействие этилбензола привело к увеличению случаев опухолей почек и яичек у самцов крыс, а также тенденции к увеличению опухолей почек у самок крыс, опухолей легких у самцов мышей и опухолей печени у самок мышей.
Национальная токсикологическая программа провела ингаляционное исследование на крысах и мышах. Воздействие этилбензола привело к увеличению случаев опухолей почек и яичек у самцов крыс, а также тенденции к увеличению опухолей почек у самок крыс, опухолей легких у самцов мышей и опухолей печени у самок мышей.
Как и все органические соединения, пары этилбензола образуют с воздухом взрывоопасную смесь. При транспортировке этилбензол классифицируется как легковоспламеняющаяся жидкость класса 3, группа упаковки II.
Экологические последствия
Этилбензол содержится в основном в виде пара в воздухе, поскольку он может легко перемещаться из воды и почвы. В 1999 году в городском воздухе была обнаружена средняя концентрация 0,62 частей на миллиард ( частей на миллиард ). Исследование, проведенное в 2012 году, показало, что в воздухе страны средняя концентрация составила 0,01 частей на миллиард (ppb), а в помещении средняя концентрация составила 1,0 частей на миллиард. Он также может выбрасываться в воздух при сжигании угля , газа и нефти . Использование этилбензола в промышленности способствует образованию паров этилбензола в воздухе. После трех дней пребывания в воздухе с помощью солнечного света другие химические вещества расщепляют этилбензол на химические вещества, которые можно найти в смоге . Поскольку он плохо связывается с почвой, он также может легко перемещаться в грунтовые воды . В поверхностных водах он разрушается, когда вступает в реакцию с химическими веществами, которые естественным образом содержатся в воде. Как правило, этилбензол не содержится в питьевой воде, однако его можно найти в колодцах с питьевой водой в жилых помещениях, если колодцы расположены рядом с свалками отходов, протекающими подземными резервуарами для хранения топлива или свалками.
Он также может выбрасываться в воздух при сжигании угля , газа и нефти . Использование этилбензола в промышленности способствует образованию паров этилбензола в воздухе. После трех дней пребывания в воздухе с помощью солнечного света другие химические вещества расщепляют этилбензол на химические вещества, которые можно найти в смоге . Поскольку он плохо связывается с почвой, он также может легко перемещаться в грунтовые воды . В поверхностных водах он разрушается, когда вступает в реакцию с химическими веществами, которые естественным образом содержатся в воде. Как правило, этилбензол не содержится в питьевой воде, однако его можно найти в колодцах с питьевой водой в жилых помещениях, если колодцы расположены рядом с свалками отходов, протекающими подземными резервуарами для хранения топлива или свалками.
С 2012 года в соответствии с Директивой ЕС по опасным веществам этилбензол не классифицируется как опасный для окружающей среды.
Этилбензол входит в состав табачного дыма .
Биоразложение
Некоторые штаммы грибка Cladophialophora могут расти на этилбензоле. Бактерия Aromatoleum aromaticum EbN1 была обнаружена благодаря ее способности расти на этилбензоле.
Рекомендации
- Национальная токсикологическая программа. Исследования токсикологии и канцерогенеза этилбензола (CAS № 100-41-4) на крысах F344 / N и мышах B6C3F1 (исследования при вдыхании). TR № 466. Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Национальные институты здравоохранения, Бетесда, Мэриленд. 1999 г.
внешние ссылки
Этилбензол, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Кумол, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Стирол, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Этилбензол — Краткий профиль — ECHA
Раздел «Идентификация вещества» связывает идентификационную информацию о веществе из всех баз данных, поддерживаемых ECHA. Идентификаторы веществ — если они доступны и не заявлены как конфиденциальные — отображаются в разделе «Идентификация вещества» Краткого профиля:
- Название / номер ЕС
- Название / номер IUPAC
- Номер CAS
- Номер индекса
- Молекулярная формула
- Smiles
- InChI
Кроме того, в этом разделе отображается информация о типе вещества, происхождении, количестве и типе зарегистрированных композиций и других местах, где это вещество указано.
Название / номер ЕС (Европейское сообщество)
Название и номер ЕС являются официальными идентификаторами веществ в Европейском Союзе и могут быть найдены в реестре ЕС.
Реестр ЕС представляет собой комбинацию трех независимых европейских списков веществ из предыдущих нормативных документов ЕС по химическим веществам (EINECS, ELINCS и NLP-list). Более подробную информацию об инвентаризации EC можно найти здесь. Если веществу не присвоен номер EC, ECHA присвоит номер списка.Эти номера начинаются с 6, 7, 8 или 9.
Более подробную информацию об инвентаризации EC можно найти здесь. Если веществу не присвоен номер EC, ECHA присвоит номер списка.Эти номера начинаются с 6, 7, 8 или 9.
Название / номер ИЮПАК
Название ИЮПАК основано на международной стандартной химической номенклатуре, установленной Международным союзом чистой и прикладной химии (ИЮПАК).
Номенклатура IUPAC — это систематический способ обозначения химических веществ, как органических, так и неорганических. В номенклатуре ИЮПАК префиксы, суффиксы и инфиксы используются для описания типа и положения функциональных групп в веществе.
Если в зарегистрированных досье REACH доступно более одного имени IUPAC, все имена IUPAC отображаются в разделе «Другие имена» краткого профиля.
Дополнительную информацию о Международном союзе чистой и прикладной химии можно найти на официальном веб-сайте ИЮПАК.
Регистрационный номер CAS (Химическая служба рефератов)
Номер CAS — это цифровой идентификатор вещества, присвоенный Химической реферативной службой, подразделением Американского химического общества, веществам, зарегистрированным в базе данных реестра CAS. С веществом может быть связано более одного номера CAS. В этом случае сначала отображается предпочтительный номер CAS.Подробнее о CAS и реестре CAS можно найти здесь.
Номер индекса
Номер индекса — это идентификационный код, присвоенный веществам в Части 3 Приложения VI к Регламенту CLP ((EC) № 1272/2008). Каждому номеру индекса соответствует четкая классификация и маркировка.
Индексный номер для каждого вещества представлен в виде последовательности цифр типа ABC-RST-VW-Y. ABC соответствует порядковому номеру наиболее характерного элемента или наиболее характерной органической группы в молекуле.RST — порядковый номер вещества в ряду ABC. VW обозначает форму, в которой вещество производится или размещается на рынке. Y — это контрольная цифра, рассчитанная в соответствии с 10-значным методом ISBN.
Молекулярная формула
Молекулярная формула идентифицирует каждый тип элемента по его химическому символу и определяет количество атомов каждого элемента в одной дискретной молекуле вещества. Если такая информация доступна в базе данных ECHA и не считается конфиденциальной, здесь будут отображаться молекулярная формула и молекулярная структура.
УЛЫБКИ
УЛЫБКИ — это аббревиатура от Simplified Molecular Input Line Entry Specification, химической системы обозначений, используемой для представления молекулярной структуры линейной цепочкой символов.
В стандартных SMILES название молекулы является синонимом ее структуры: оно косвенно показывает двумерную картину молекулярной структуры. Поскольку двумерную химическую структуру можно нарисовать различными способами, существует несколько правильных обозначений SMILES для одной молекулы.
В основе SMILES лежит представление валентной модели молекулы. Обозначения SMILES состоят из атомов (обозначенных символами элементов), связей, скобок (используются для обозначения ветвления) и чисел (используются для циклических структур).
InChI
InChI — это сокращенное название Международного химического идентификатора IUPAC, химического идентификатора, разработанного и поддерживаемого InChI Trust.
InChI состоят из текстовых строк, содержащих различные слои и подслои информации, разделенные косой чертой (/).Каждая строка InChI начинается с номера версии InChI, за которым следует основной уровень. Этот основной слой содержит подслои для химической формулы, атомных связей и атомов водорода. В зависимости от структуры молекулы за основным слоем могут следовать дополнительные слои, например для заряда, стереохимической и / или изотопной информации.
Молекулярная структура
Молекулярная структура, отображаемая в этом разделе, основана на аннотации InChI из базы данных эталонных веществ IUCLID и хранится в базе данных ECHA.Структура — это компьютерная визуализация молекулярной структуры, полученная из строки символов InChI.
Тип вещества
Зарегистрированные лица могут идентифицировать свое вещество как однокомпонентное, многокомпонентное вещество, UVCB, полимер или указать другой тип. Если зарегистрировано более одного типа вещества, будут отображаться оба типа.
Происхождение
Зарегистрированные лица могут идентифицировать происхождение своего вещества как:
- Элемент
- Неорганическое
- Органическое
- Металлоорганическое
- Нефтепродукт
- Другое
Если зарегистрировано более одного типа вещества , будут отображаться оба типа.
Зарегистрированные композиции (добавки и примеси)
Здесь отображается общее количество неконфиденциальных зарегистрированных композиций, представленных в досье REACH. Если есть добавки и примеси, относящиеся к классификации веществ, они также указываются.
В контексте REACH примеси являются непреднамеренными составляющими, присутствующими в производимом веществе. Например, он может происходить из исходных материалов или быть результатом вторичных или неполных реакций в процессе производства.Хотя он присутствует в конечном веществе, он не был добавлен намеренно. В большинстве случаев примеси составляют менее 10% вещества.
Добавки — это компоненты, которые были намеренно добавлены в процессе производства для стабилизации вещества.
Вещество включено в список
Предоставляет информацию, если вещество было идентифицировано одной из следующих предыдущих нормативных баз ЕС по химическим веществам:
- EINECS (Европейский перечень существующих коммерческих химических веществ) Список
- ELINCS (Европейский список нотифицированных химических веществ) Вещества) Список
- Список NLP (не более длительные полимеры)
Этилбензол — Справочник по химической экономике (CEH)
Опубликован 31 января 2020 г.
Этилбензол (EB) представляет собой легковоспламеняющуюся бесцветную жидкость со сладким ароматом что бензина.Почти весь производимый в мире этилбензол используется для производства стирола; Таким образом, потребность в этилбензоле в первую очередь определяется производством стирола. Стирол используется в основном в производстве полимеров для производства полистирола, акрилонитрилбутадиен-стирольных (ABS) и стирол-акрилонитриловых (SAN) смол, стирол-бутадиеновых эластомеров и латексов, а также ненасыщенных полиэфирных смол. Основные рынки индустрии стирола включают упаковку, электрическую / электронную / бытовую технику, строительство и потребительские товары.Потребление этилбензола для целей, отличных от производства стирола, оценивается примерно в 2%. Эти применения включают использование в качестве растворителя и, иногда, производство диэтилбензола, ацетофенона и этилантрахинона.
Следующая круговая диаграмма показывает мировое потребление этилбензола:
В 2019 году общий спрос на этилбензол составил примерно 32,1 миллиона метрических тонн, что соответствует среднегодовому увеличению на 1,8% за последние пять лет. Из этого количества 408 000 метрических тонн этилбензола попали в категорию «Прочие», где этилбензол используется для использования в качестве растворителей, а иногда и для производства диэтилбензола, ацетофенона и этилантрахинона.Северо-Восточная Азия, Северная Америка, Западная Европа, Центральная Европа и Южная Америка были единственными регионами, где этилбензол потреблялся для других целей в 2019 году.
Полистирол (ПС) — это сектор наибольшего спроса на стирол, на который приходится 34% мирового спроса на стирол. Другие основные виды использования стирола и их доли в 2019 году включают вспениваемый полистирол (22%), смолы ABS (18%), ненасыщенные полиэфирные смолы (6%), латекс SB (5%) и каучук SB (4%).
Полистирол подразделяется на два типа: полистирол общего назначения (GPPS) и ударопрочный полистирол (HIPS).Полистирол общего назначения представляет собой прозрачный кристаллический полимер, который может иметь различные свойства, такие как индекс текучести расплава и химическая стойкость, среди прочего. Ударопрочный полистирол содержит около 7% полибутадиена, привитого к полимеру стирола. Для получения более подробной информации см. Отчет CEHStyrene.
Северо-Восточная Азия является доминирующим игроком в отрасли этилбензола, на которую приходится 47% и 49% мировых производственных мощностей и потребления, соответственно. Китай является основным драйвером, на его долю приходится 57% регионального потенциала и 53% регионального спроса по состоянию на 2019 год.Китай также будет самой быстрорастущей страной в прогнозе по этилбензолу, с ожидаемым среднегодовым приростом 7,6% в период с 2019 по 2024 год. Страны СНГ и Балтии будут на втором месте с ожидаемыми среднегодовыми темпами роста около 1,7. % в течение следующих пяти лет.
Всего в мире насчитывалось 89 производителей этилбензола в 2017 году. На 15 крупнейших производителей приходилось более 58% от общей мощности в 2019 году. INEOS Styrolution — крупнейший производитель с производственными мощностями в Северной Америке и Западной Европе, а также рядом с ними. 7.Доля мощностей в 1% в 2019 году. Следующие два места занимают Royal Dutch / Shell и SINOPEC, на которые приходится около 6,7% и 6,2% долей мощности соответственно.
Мировой спрос на этилбензол будет расти примерно на 2% в год в течение прогнозируемого периода.
Для получения более подробной информации см. Приведенное ниже содержание.
Справочник IHS Markit по экономике химической промышленности — Этилбензол — это исчерпывающее и надежное руководство для всех, кто ищет информацию об этой отрасли.В этом последнем отчете представлена глобальная и региональная информация, включая
Ключевые преимущества
Справочник IHS Markit по экономике химической промышленности — Этилбензол был составлен на основе первичных интервью с ключевыми поставщиками и организациями, а также ведущими представителями промышленности в сочетании с беспрецедентным доступом IHS Markit к аналитическим данным о рынке в сфере добычи и сбыта продукции, а также экспертным анализом динамики отрасли, торговли и экономики.
Этот отчет может помочь вам
- Определить тенденции и движущие силы, влияющие на химические рынки
- Прогноз и план будущего спроса
- Понять влияние конкурирующих материалов
- Выявить и оценить потенциальных клиентов и конкурентов
- Оценить производителей
- Track изменение цен и торговых движений
- Проанализировать влияние сырья, нормативных требований и других факторов на химическую прибыльность
Категория: ароматизаторы США / ЕС / FDA / JECFA / FEMA / FLAVIS / Ученый / Патентная информация: Физические свойства:
Органолептические свойства:
Косметическая информация: Поставщиков: Информация по безопасности:
Информация о безопасности использования: Ссылки по безопасности: Артикул: Другая информация: Примечание о потенциальных блендерах и основных компонентахВозможное использование: Возникновение (природа, еда, прочее): примечаниеСинонимов:
Статей: | |
Этилбензол, стирол из — Big Chemical Encyclopedia
Алкенилгалогениды, такие как винилхлорид (h3C = CHC1), не образуют карбокатионов при обработке хлоридом алюминия и поэтому не могут использоваться в реакциях Фриделя-Крафтса Таким образом, промышленное получение стирола из бензола и этилен не включает винилхлорид, а образует этилбензол… [Pg.483]Дегидрирование (Раздел 5 1) Отщепление, при котором h3 теряется из соседних атомов Этот термин чаще всего используется при получении этилена из этана пропена из пропана 1 3 бутадиена из бутана и стирола из этилбензола … [Pg.1281]
Стирол производится из этилбензола. Этилбензол [100-41-4] получают путем алкилирования бензола этиленом, за исключением очень небольшой фракции, которую извлекают из смешанных ароматических углеводородов Cg суперфракционированием.Установки этилбензола и стирола почти всегда устанавливаются вместе с соответствующими мощностями, потому что почти весь производимый коммерчески этилбензол превращается в стирол. Алкилирование экзотермично, а дегидрирование эндотермично. В типичном комплексе этилбензол-стирол экономия энергии достигается за счет преимущественного объединения потоков энергии двух установок. Завод, предназначенный для производства этилбензола исключительно или в основном для коммерческого рынка, также не считается жизнеспособным, поскольку торговый рынок является небольшим и спорадическим.[Pg.477]
Этиленовое сырье, используемое на большинстве заводов, имеет высокую чистоту и содержит 200–2000 частей на миллион этана в качестве единственной значительной примеси. Этан инертен в реакторе и выбрасывается из установки с отходящим газом для использования в качестве топлива. Потоки разбавленного газа, такие как отходящий газ очищенного каталитического крекинга с псевдоожиженным слоем (FCC) с нефтеперерабатывающих заводов с концентрацией этилена всего лишь 10%, также использовались в качестве этиленового сырья. Отходящий газ FCC на нефтеперерабатывающем заводе, который иначе используется в качестве топлива, может быть привлекательным источником этилена даже при дополнительных затратах на обработку, необходимую для удаления нежелательных примесей, таких как ацетилен и высшие олефины.Однако его использование для производства этилбензола ограничено доступным количеством. Только крупные нефтеперерабатывающие заводы способны производить достаточное количество отходящего газа FCC, чтобы поддерживать экономичную установку этилбензола-стирола. [Pg.478]
На рисунке 5 показана типичная линия дистилляции на установке по производству стирола. Побочные продукты бензола и толуола извлекаются в верхний погон бензол-толуольной колонны. Кубовый остаток из бензол-толуольной колонны перегоняется в рециркуляционной колонне этилбензола, где происходит разделение этилбензола и стирола.Этилбензол, содержащий до 3% стирола, отводится наверх и возвращается в секцию дегидрирования. Кубовый остаток, который содержит стирол, побочные продукты тяжелее стирола, полимеры, ингибитор и до 1000 ppm этилбензола, перекачивается в колонну чистовой обработки стирола. Верхний погон из этой колонны представляет собой очищенный стирол. Кубовый остаток дополнительно обрабатывается в системе очистки остатков для извлечения дополнительного количества стирола из остатка, который состоит из тяжелых побочных продуктов, полимеров и ингибитора.Остаток используется как топливо. Система очистки остатка может быть испарителем мгновенного действия или небольшой дистилляционной колонной. Эта последовательность перегонки используется в процессах Fina-Badger и Dow. [Pg.483]
Коммерческие полистиролы обычно представляют собой довольно чистые полимеры. Количество стирола, этилбензола, димеров и тримеров стирола и других углеводородов сводится к минимуму за счет эффективного удаления летучих веществ или за счет использования химических инициаторов (33). Полистиролы с низким общим содержанием летучих веществ имеют относительно высокие температуры термической деформации.Очень низкое содержание мономера и других растворителей, например этилбензола, в ПС желательно при упаковке пищевых продуктов. Незначительный уровень извлечения органических материалов из полистирола имеет решающее значение в этом приложении. [Pg.505]
Существуют известные случаи, когда тарельчатые колонны были преобразованы в насадочные колонны, чтобы получить преимущество низкого перепада давления, возникающего в потоке пара. В последнее время насадки в основном были структурного типа. Иллюстрацией этого является тенденция к использованию структурированной насадки в ректификационных установках этилбензол-стирол, некоторые из которых имеют диаметр 10 м и более.[Стр.174]
Пример 4 Стирол из этилбензола Основная реакция при дегидрировании этилбензола — это стирол и водород. [Pg.2080]
Генерация caibocations из этих источников хорошо задокументирована (см. Раздел 5.4). Реакция ароматических углеводородов с алкенами в присутствии кислотных катализаторов Льюиса является основой промышленного производства многих алкилированных ароматических соединений. Стирол, например, получают дегидрированием этилбензола из бензола и этилена.[Pg.583]
Данные существующей системы сбора были проанализированы на предмет видов отказов и распределения. Результаты анализа Парето указывают на основные причины отказа. Для насосов этиленового завода (85 центробежных насосов с электрическим приводом за 19 месяцев) и оборудования завода по производству этилбензол-стирольного мономера по данным за 10 месяцев приведены несколько значений среднего времени до технического обслуживания (MTBM) 4 газовых компрессора, 3 винтовых конвейера , 121 насос и 235 других предметов … [Стр.46]
Задача 16.21 Стирол, простейший алкенилбензол, коммерчески готовится для использования в производстве пластмасс путем каталитического дегидрирования этилбензола. Как можно получить стирол из бензола с помощью изученных вами реакций … [Pg.579]
Реакция эпоксидирования олефинов надкислотами была открыта Прилежаевым [235]. Первое наблюдение, касающееся каталитического эпоксидирования олефинов, было сделано в 1950 году Хокинсом [236]. Он обнаружил образование оксида из циклогексена и 1-октана при разложении гидропероксида кумила в среде этих углеводородов в присутствии пентаоксида ванадия.С 1963 по 1965 год компания Halcon Co. разработала и запатентовала процесс получения пропиленоксида и стирола из пропилена и этилбензола, ключевой стадией которого является каталитическое эпоксидирование пропилена гидропероксидом этилбензола [237 238]. В 1965 г. Индиктор и Брилл [239] опубликовали исследования эпоксидирования некоторых олефинов 1,1-диметилэтилгидропероксидом, катализируемого ацетилацетонатами нескольких металлов. Они наблюдали высокий выход оксида (близкий к 100% по гидропероксиду) для катализа ацетилацетонатами молибдена, ванадия и хрома.Низкий выход оксида (15-28%) наблюдается при катализе ацетилацетонатами марганца, кобальта, железа и меди. Дальнейшие исследования показали, что молибден, ванадий и … [Pg.415]
Этилбензол — это нефтехимический продукт в больших объемах, используемый в качестве сырья для производства стирола путем дегидрирования. Этилбензол в настоящее время получают путем этиленового алкилирования бензола и его можно очищать до 99,9%. Заводы по производству этилбензола и стирола обычно строятся в одном месте. Этилбензол продается очень мало, а производство стирола составляет около 30х10 т / год.Для того чтобы селективная адсорбция была экономически конкурентоспособной в этом масштабе, потребуются потоки с достаточно высокой концентрацией и объемом этилбензола. Следовательно, несмотря на наличие технологии экстракции этилбензола из смешанных ксилолов, потенциальные коммерческие возможности ограничиваются нишевыми приложениями. [Pg.244]
Побочные продукты бензола и толуола рекуперируются в верхнем погоне дистилляционной колонны бензол-толуол. Кубовый остаток из бензол-толуольной колонны перегоняется в рециркуляционной колонне этилбензола, где происходит разделение этилбензола и стирола.Днища перекачиваются в колонну отделки стирола. Верхний погон из этой колонны представляет собой очищенный стирол. Кубовый остаток дополнительно обрабатывается в системе очистки остатков для извлечения дополнительного количества стирола из остатка. [Pg.1555]
| Рис. 1.7. Процесс получения стирола из этилбензола с использованием IS молей пара на 1 моль этилбензола. Рабочее давление 1 бар. Конверсия за проход 0,40. Общая относительная доходность 0,90 … |
Промышленный интерес к этой реакции был стимулирован открытием того, что она представляет собой коммерчески привлекательный путь к пропиленоксиду 426a, b Таким образом, катализируемый металлами Эпоксидирование пропилена с помощью этилбензолгидропероксида составляет основу процесса Halcon 426a, b 427 для совместного производства пропиленоксида и стирола из пропилена, этилбензола и кислорода через следующую последовательность … [Pg.345]
Gramshaw, J.W., and Vandenburg, H.J., 1995. Анализ состава термореактивного полиэфира и миграции этилбензола и стирола из термоотверждаемого полиэфира в свинину во время приготовления. Продовольственная добавка. и Contam. 12, 2, 223-234. [Pg.391]
Пример 2 Синтез стирольного способа. Стирол, мономер полистирола, за последние два десятилетия быстро вырос на рынке. Его получают, исходя из бензола и этилена, которые реагируют с образованием этилбензола, этилбензол дегидрируют с образованием стирола.Доступна дополнительная информация о производстве, свойствах и использовании стирола. 3 В этом примере будут проиллюстрированы этапы синтеза процесса получения стирола из этилбензола. Процедура аналогична процедуре, применяемой в программе PIP. [Pg.118]
Общая фракционная степень реакции менее 1,0 (0,5 в этом примере) означает, что не весь реагент в сырье вступает в реакцию, поэтому непрореагировавший реагент присутствует в потоке реактора и продукта. Последний поток содержит этилбензол, все продукты реакции, побочные продукты и пар.Важно отделить основной продукт, стирол, от остальной смеси. С экономической точки зрения желательно и обычно необходимо извлекать непрореагировавшие реагенты и возвращать их в реактор. Побочные продукты необходимо разделять и, по возможности, эффективно утилизировать. Конденсированный пар необходимо отделить от потока продукта и удалить. [Стр.120]
EPA 1989d. Национальные стандарты выбросов опасных веществ, загрязняющих воздух. Выбросы бензола с заводов по производству малеинового ангидрида, этилбензола / стирола, резервуаров для хранения бензола, утечек бензольного оборудования и заводов по утилизации побочных продуктов кокса.Агентство по охране окружающей среды США. 54 FR 38044. [Pg.374]
Термические реакции дигидробензо [c] фурана 258 были изучены за отраженными ударными волнами в одиночной импульсной ударной трубе в диапазоне температур 1050-1300 K с образованием продуктов мономолекулярного расщепления 258. Что интересно, оксид углерода и толуол были среди продуктов с наибольшей концентрацией, в то время как бензо [f] фуран, бензол, этилбензол, стирол, этилен, метан и ацетилен были другими продуктами. Также были обнаружены следовые количества аллена и пропина.[Pg.473]
ETHYLBENZENE ▷ Французский перевод — Примеры использования этилбензола в предложении на английском языке
ETHYLBENZENE ▷ Французский перевод — Примеры использования этилбензола в предложении на английском языке Анализ этилбензола и ксилолов в лаборатории IRSST. Проанализируйте метилбензол и ксилены в лаборатории IRSST.Данные о биоконцентрации и биологическом периоде полураспада этилбензола отсутствуют. Il n’existe pas de données sur la bioconcentration et la demi-vie biologique de l’éthylbenzène .Окончательные данные, касающиеся хронической токсичности этилбензола , отсутствуют. Il n’existe pas de données définitives sur laxicité chronique de l’éthylbenzène .Углеводороды, включая бензол, толуол, , этилбензол, и ксилолы, полициклические ароматические углеводороды, растворители, свинец. Углеводороды, не бензин, толуен, , этилбензен, и ксилены, углеводороды, полициклические ароматические вещества, растворители, пломб.Что касается сомнений Комиссии, что […] первоначальная емкость т ч e этилбензол / s t год ene unit, при 200 […]тыс. Т / год, что выше заявленного […]в рамках первоначального разбирательства по статье 88 (2) Германия признала, что в то время эта правоспособность не была прямо указана Комиссии. eur-lex.europa.eu | En ce qui Concerne les soupons de la […]Commission que la capacity initiale de […] l’unit de p roduc tio n d ‘thylbenzne / st yr ne, d e 200 kt / an, […]soit plus leve que ce qui avait […]коммюнике о кадрах первичной процедуры по статье 88, параграф 2, Аллеманье, в котором содержится информация о допустимых возможностях, льготный период, когда нет упоминания о выражении комиссии. eur-lex.europa.eu |
| В отношении т ч e этилбензол / s t год ene unit, Германия […] представила доказательства в обоих случаях, что первоначальная емкость уведомила […]в Комиссию в соответствии с первоначальным разбирательством по статье 88 (2) составило 200 тыс. Тонн в год, а стоимость увеличения мощности этой установки с 200 до 280 тыс. Тонн в год была ограничена лишь 33 миллионами немецких марок. eur-lex.europa.eu | En ce qui Concerne l’unit […] de pr od uctio n d ‘thylbenzne / st yrne , l’Allemagne […]a, dans les deux cas, dmontr que la capacity […]initiale, коммюнике Комиссии по обращению за первоочередной процедурой по открытой процедуре по статье 88, параграф 2, за 200 узл. / Год и за переходы на увеличение емкости на 200 280 узл. / Год se limitaient 33 миллиона немецких марок. eur-lex.europa.eu |
Установка мономера стирола в настоящее время работает с использованием […] отгрузка s o f этилбензол f r om NOVA Chemicals ‘Sarnia, Ontario производственное предприятие и дополнительная закупка s ontario obenzene .novachem.com | L’unit de Fabrication de […] monomre de styrne est exploite actuellement gr ce l ‘ thylbenzne en prov en ance de l’usine d e NOVA en de. ..]Ontario, et des achats d’appoint. novachem.com |
| 11 июня 2003 г. в компании NOVA Chemicals произошел взрыв, в результате которого возник пожар на производственной установке т h e этилбензол м a nu в Бейпорте, штат Техас. , производство мономеров стирола. novachem.com | 11 июля 2003 г. произошел взрыв, провоцирующий поджог в блоке по изготовлению метилбензола для производства мономерного стирна компании NOVA Chemicals, Бейпорт, штат Техас. novachem.com |
| Расширение т ч e этилбензол / s t год еновый блок был […] добавлено к плану реструктуризации вместо платежей за «структурный дефицит», которые Комиссия не смогла принять. eur-lex.europa.eu | L’agrandissement de […] l’unit de p ro ducti on d’thylbenzne / sty rne a t ajout […]au plan de restructuration en lieu et place de la компенсация деформируемых структур, […]que la Commission ne pouvait pas autoriser. eur-lex.europa.eu |
В четвертом квартале установка мономера стирола в Бейпорте […]продолжал работать, используя […] отгрузка s o f этилбензол f r om NOVA Chemicals ‘Sarnia, Ontario производственное предприятие и дополнительная закупка s ontario obenzene .novachem.com | Au quatrime trimestre, производственная единица мономера […] […] Стирн де Байпорт непрерывная эксплуатация г rce л ‘тилбензин prov enan t de l’usine d e NOVA C enan , […]et des achats d’appoint. novachem.com |
| Этилбензол u n it Ремонтные работы ведутся и, как ожидается, объект в Бейпорте будет […] полностью введен в эксплуатацию в начале 2004 года. novachem.com | L’installation de Bayport devrait fonctionner Pleine Capacit au dbut de 2004. novachem.com |
| Залив po r t этилбензол u n it , поврежденный в результате пожара в июне 2003 года, был перезапущен 18 января 2004 года и работал на полную мощность. . новачем.com | L’unit de fabrication d’thylbenzne de Bayport, endommage en juin 2003 par un incendie, реприза к производству 18 января 2004 года и fonctionne plein rgime. novachem.com |
Улучшение в квартале произошло за счет более высоких продаж […]тома и снятие с производства […] покупка третьей стороной s o f этилбензол , a s стирол Bayport […] Установкамономера снова заработала в конце января. novachem.com | L’amlioration du premier trimestre est due une […]hausse des volume des ventes et […] l’arrt d es acha ts d’thylbenzne de s tie rs , en raison […]de la reprise des Activities de […]L’unit de Fabrication de Styrne de Bayport, la fin janvier. novachem.com |
Из-за относительно долгой истории […] управление толу en e , этилбензол a n d ксилолы («TEX») […]как целевые соединения, они также исключены из PHC. ccme.ca | L e tolu ne , l ‘thylbenzne et les xyl ne s (TEX […] ) sont galement exclus des HCP, puisqu’ils sont grs en tant que composs […]cibles depuis une priode de temps relativement longue. ccme.ca |
смешанные ксилолы, состоящие из смеси […] 80-85% изомеров и 15 -2 0 % этилбензол .cedre.fr | le mix-xylnes, compos du mlange […] d’isomres 8 0-85 % e t d ‘тилбензол 1 5-2 0% .cedre.fr |
Состоит из […] смесь 80-85% изомеров и 15 -2 0 % этилбензолcedre.fr | Compos du mlange […] d’isomres 80 -85 % et d’thylbenzne 15 — 2 0cedre.fr |
Произведена полная модернизация завода, в том числе […] установка n e w этилбензол u n it .novachem.com | Использовать комплексную модернизацию и модернизацию установки […] une nouv el le un it d ‘thylbenzne .novachem.com |
Установка мономера стирола на […] Бэйпорт возобновил работу 18 августа 2003 г. после взрыва и пожара в июне 2003 г. на участке факторизации т ч e этилбензол м a nu .novachem.com | L’usine de production de monomre de styrne de Bayport, au Texas, a […]повторения ses activits […] le 18 aot 2003 aprs une interrupt en juin 2003, из-за взрыва и зажигания в ‘u nit de fabr ic ation […]d’thylbenzne. novachem.com |
Ксилолы испаряются из поверхностных вод; расчетный период полураспада смешанных изомеров в воздухе от 16 до 28 […] часов и 1 день f o r этилбензол .cedre.fr | vie Calcul du mlange d’isomres dans l’air est de 16 28 heures […] et d’u n jour pou r l’thylbenzne .cedre.fr |
| В условиях двухлетних ингаляционных исследований, проведенных Национальной токсикологической программой (NTP), были четкие доказательства канцерогенной активности y o f этилбензол i n m эля крыс на основании увеличения частоты новообразований почечных канальцев. uap.ca | Dans les conditions d’tudes d’inhalation d’une dure de 2 ANS, Rralises par le National Toxicology Program (NTP) des tats-Unis, l’action cancrogne de l’thylbenzne and clairement tablie chez les rats mles en raison d ‘ Увеличение опухоли канальцев. uap.ca |
Шесть оцененных токсичных веществ в воздухе: бензол, МТБЭ, ртуть, […] н-гексан, толуол a n d этилбензол .ccme.ca | «Шесть загрязняющих веществ, атмосферных токсикантов», «ле-бензн», «Ле МТБЭ», «Ле Меркурий», «Ле […] нгексан, le — lune et l ‘ thylbenzne .ccme.ca |
Официальная экспертная оценка Совета министров Канады […]Environment (CCME) почвенные документы на […] бензол, толу en e , этилбензол , x ил ены и ПАУ; […]и пересмотренного протокола CCME […]для вывода здоровья человека. hc-sc.gc.ca | Examen officiel par les pair des […]документов на портале […] benzne, l e tolu ne , l ‘thylbenzne, le s x yln es et les […]углеводороды, ароматические полициклики […]du Conseil canadien des ministres de l’Environnement (CCME), et du protocole rvis d’laboration de recmandations sur la sant humaine du CCME. hc-sc.gc.ca |
Из-за отключения электроэнергии результаты NOVA Chemicals за четвертый квартал сократились примерно на $ 6 . […]млн (после уплаты налогов), в связи с более высоким […] затраты от покупки как e d этилбензол , l ow er эксплуатационные расходы […]и расходы, не покрываемые страховкой. novachem.com | Прерывание производства и сокращение результатов деятельности NOVA Chemicals в окружающей среде 6 миллионов долларов (прибавки и налоги) на сумму […]quatrime trimestre, en raison des cots […] lev s de l ‘ ach at d’thylbenzne, d’u ne dimin ut ion des […]taux d’exploitation et des cots non couverts par l’assurance. novachem.com |
| Толуол a n d этилбензол d e mo nstrate гидрофобные свойства, фенол и этилбензоат нейтральные полярные взаимодействия. merck-chemicals.com | Le tolune e t l ‘ thylbenzne met te nt en vidence les proprits Hydrophobes; les взаимодействий polaires нейтралы peuvent tre изучает l’aide de phnol e t de b en zoate […] d’thyle. merck-chemicals.fr |
Считается, что побочные продукты завода по газификации угля, работавшего с 1854 по 1947 год к северу от пирса Мейерс, мигрировали по открытой канаве на прибрежную свалку: «Исторические методы землепользования привели к загрязнению, захороненному на территории, включая различные тяжелые металлы (например,г., медь, свинец и цинк), некоторые полициклические ароматические углеводороды, […]и углеводороды нефтяные, в том числе […] BTEX (бензол, толу en e , этилбензол a n d ксилол) и всего […]углеводородов нефтяных. hc-sc.gc.ca | On croit que les sous-produits d’une usine de gazification du charbon qui at exploite, de 1854 1947, juste au Nord de la Jete Meyers ont migr par un foss simple jusqu ‘la dcharge prs du rivage: Les pratiques pass d’ утилизация земель, находящихся на втягивании загрязненных территорий, без водолазных работ (стр.напр. cuivre, plomb et zinc), некоторые углеводороды, ароматические полициклики, des […]Контроллеры углеводородов, аналог […] BTEX (ben z ne, tolu n e, thylbenzne et x yln e) e t des углеводороды […]ptroliers totaux. hc-sc.gc.ca |
| Из-за отключения выручка NOVA Chemicals в третьем квартале сократилась примерно на 4 миллиона долларов (после вычета налогов) из-за более высоких затрат, связанных с покупкой и отгрузкой. novachem.com | L’interruption de la production a Entran une diminution du bnfice d’environ 4 миллиона долларов (aprs impts et tax) au troisime trimestre, en raison des cots levs de l ‘achat et de la livraison d’ тилбензол. novachem.com |
Кроме того, предлагаемое приобретение приведет к появлению нескольких […]вертикальных отношений, в основном по отношению к […] этилен, циклогекс и e , этилбензол a n d метил третичный […]бутиловый эфир (МТБЭ). europa.eu | L’acquisition envisage engendrerait en outre plusieurs Relations verticales, […]Principalement pour ce qui est de l’thylne, du […] cyclohe xa ne, d e l ‘thylbenzne et du m th ил-трет-бутил-тер (MTBE).europa.eu |
Образцы почвы были взяты из четырех разных мест и […] проанализирован на бенз en e , этилбензол , t ол уол, ксилолы, […]углеводороды нефтяные F1 (C6-C10), […]F2 (C10-C16), F3 (C16-C34), F4 (C34-C50) и ведущий. ccme.ca | Des chantillons de sols ont t prlevs en quatre emplacements diffrents, et […]анализатор для терминалов […] концентрации en b en zne , en thylbenzne, en tolu n e, en […]ксилны и углеводороды […]дробей F1 (C6 C10), F2 (C10 C16), F3 (C16 C34) и F4 (C34 C50) и др. ccme.ca |
Бензол широко используется в промышленности как летучий растворитель и […]промежуточное звено в производстве многих […] химические вещества, включая ди n г этилбензол / s t год ен, кумол и […]малеиновый ангидрид (Jaques, 1990). hc-sc.gc.ca | Le benzne est trs utilis dans l’industrie com solvant volatil et com intermdiaire pour la production […]d’un grand nombre de produits […] chimique s, y c ompr is l’thylbenzne-st yr ne, le cu mne et […]l’anhydride malique (Jaques, 1990). hc-sc.gc.ca |
Планируется разработать руководящие принципы для следующих веществ PSL: бензидин, монохлорбензол, 1,2-дихлорбензол, 1,4-дихлорбензол, трихлорбензол, тетрахлорбензол, […]пентахлорбензол, гексахлорбензол, мышьяк, […] толуол, бенз en e , этилбензол a n d компоненты […]сбросов хлорированных сточных вод (нитрат, […]фосфат, аммиак, хлорамины, биологическая потребность в кислороде (БПК), растворенный кислород (DO), взвешенные твердые частицы, свободный остаточный хлор и питательные вещества) для водоприемников. эк.gc.ca | On prvoit laborer des recmandations to les suivantes de la LSIP: la benzidine, le chlorobenzne, le 1,2-dichlorobenzne, le 1,4-dichlorobenzne, les trichlorobenznes, les ttrachlorobenznes, le pentachlorobenzne, […]l’hexachlorobenzne, l’arsenic, le […] tolune, l e benz ne, l ‘thylbenzne et , po ur l es eaux […]rceptrices, les composants des eaux […]использует хлор (нитрат, фосфат, аммиак, хлорамины, demande biochimique en oxygne, oxygne disous, твердые вещества в суспензии, chlore rsiduel libre et lments нутритивы). ec.gc.ca |
| У нас есть бензол, толу и и , этилбензол , и и ксилолов в […] наша вода. www2.parl.gc.ca | Nous avons dans notre eau du benzne, […] по lu ne, de l ‘thylbenzne et d es x yl nes.www2.parl.gc.ca |
| ароматическое сырье, которое содержит ксилолы a n d этилбензол , t he процесс, включающий стадии: (a) воздействие на указанное сырье t o этилбензол c o nv на первой стадии для обеспечения первого сточного потока […] поток; (б) удаление C9 v3.espacenet.com | qui contient des […] xylnes e t de l ‘ thylbenzne, procd comprenant les tape consistant: (a) суметровая загрузка и преобразование метилбензола в предварительную ленту p или r produire u n премьер […]сточных вод; (б) […]Запасные части ароматических композиций в C9 v3.espacenet.com |
Фактически они сказали, что семь из семи добываемой воды из угольного пласта […] […] метановые скважины содержали загрязнители, которые мы обнаружили в нашей питьевой воде Rosebud — бензол, толу и e , этилбензол , e tc , но более тяжелые углеводороды. 11 из 12 колодцев, участвовавших в исследовании, не имели, не имели […]обнаруживаемых уровня. www2.parl.gc.ca | Elle a dit que l’eau provantant de sept puits de mthane houiller sur sept contenait les mmes contaminants que ceux dcels dans notre eau potable Rosebud: le benzne, le tolune, l’thylbenzne, etc. |


 )
) — 2656 p. — ISBN 0-8493-0486-5. (англ.)
— 2656 p. — ISBN 0-8493-0486-5. (англ.)
 | ред. код]
| ред. код]