Из чего состоит автомобильный аккумулятор
В наши дни сложно найти человека, который бы не знал, что такое аккумуляторная батарея. Они используются в разных сферах нашей жизни – бытовой технике, легковых автомобилях, грузовиках, специальной технике, самолетах и многих других.
Состоит любой источник питания из аккумуляторных пластин, сделанных из сплава свинца с разными добавками. Корпус заполнен электролитом, который взаимодействуя со свинцом, способствует выработке электричества.
По такому принципу построены любые аккумуляторные батареи, так как только в таком варианте можно получить ток. Изменения могут касаться состава сплава электродов и электролита. В автомобильных используется свинец с разными добавками, а электролит представляет из себя водный раствор серной кислоты.
Именно потому, что внутри находится кислота, с аккумуляторными батареями всегда нужно обращаться очень аккуратно.
Не стоит забывать и о чистоте контактов. На клеммах в процессе эксплуатации аккумулятора образуется налет окислов, снижающий электропроводимость. Зачистить контакты можно с помощью обычной наждачной бумаги, тогда соединение будет надежным и прочным, а ток будет беспрепятственно переходить от батареи к электросистеме вашего автомобиля.
При покупке аккумулятора вы можете выбрать тип батареи, которая по своим рабочим показателям будет оптимально подходить для вашей машины. В частности вы можете выбирать не только по емкости или силе стартового тока, но и по технологии производства аккумулятора. Сейчас в магазинах можно найти АКБ нескольких разновидностей.
— Кислотные с жидким электролитом пластины в них могут быть свинцовые или кальциевые.
— Необслуживаемые гелевые.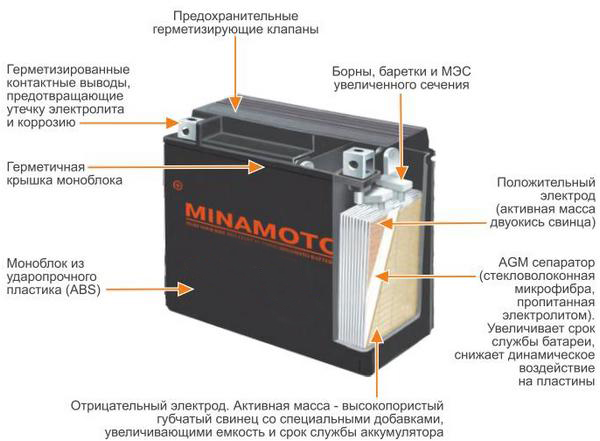 В них используется загущенный электролит.
В них используется загущенный электролит.
— AGM батареи с абсорбированным электролитом, который пропитывает специальное волокно. Это также разновидность необслуживаемых авто аккумуляторов.
Электромобили спровоцировали борьбу за металлы
Прогнозируемый рост мирового спроса на электромобили заставляет автопроизводителей озаботиться наличием сырья для выпуска аккумуляторов. К нему относятся литий, никель, кобальт, графит и редкоземельные металлы. Поэтому производители электромобилей и аккумуляторов стремятся обеспечить их поставки, договариваясь с горнодобывающими компаниями.
По данным Международного энергетического агентства (МЭА), в прошлом году в мире было 2 млн электромобилей. К 2040 г. их число достигнет минимум 40 млн, прогнозирует МЭА. И крупнейшие горнодобывающие компании уже начали менять свой бизнес, чтобы обеспечить поставку материалов для литий-ионных аккумуляторов. Нынешний год должен стать «переломным моментом» для электромобилей, заявила BHP Billiton.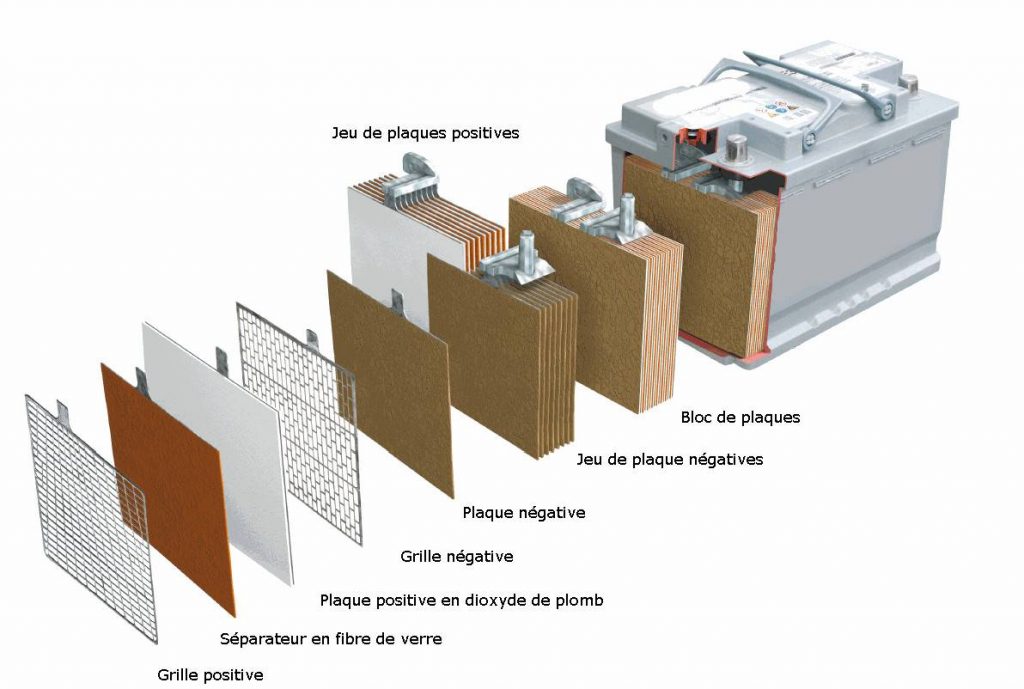
В сентябре китайский автопроизводитель Great Wall Motor подписал соглашение с австралийской Pilbara Minerals об обеспечении себе поставок лития на пять лет. В октябре другая австралийская горнодобывающая компания, Galaxy Resources, сообщила, что ведет переговоры о долгосрочных поставках лития с несколькими производителями автомобилей и аккумуляторов. В их число входит Panasonic, выпускающая аккумуляторы для Tesla. «Это подчеркивает, какое стратегическое значение для мировой автомобильной промышленности приобретает доступ к крупным, надежным и высококачественным источникам материалов для аккумуляторов в странах с низким риском», – заявил гендиректор Pilbara Кен Бринсден.
Спекулянты тоже не остаются в стороне, так как эти металлы сильно дорожают; их возросшая активность на рынке еще больше толкает цены вверх. Инвесткомпания Cobalt 27 уже закупила более 2000 т кобальта. Этот металл подорожал более чем на 190% за последние полтора года. Обеспечить поставки кобальта труднее всего, поскольку 65% его добычи приходится на Демократическую Республику Конго (ДРК), одну из беднейших стран мира.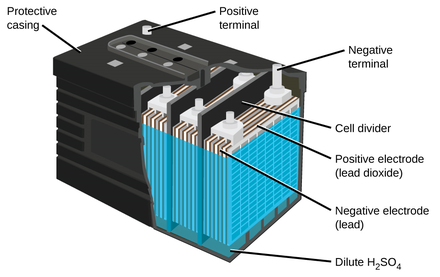 По прогнозам аналитиков UBS, спрос на кобальт удвоится к 2020 г. примерно до 200 000 т в год. Поэтому потребуются новые проекты, чтобы избежать его дефицита в долгосрочной перспективе. «Без кобальта из ДРК вообще нельзя будет говорить о производстве электромобилей – вот насколько рынку нужно больше этого металла», – утверждает Саймон Мурс из Benchmark Mineral Intelligence.
По прогнозам аналитиков UBS, спрос на кобальт удвоится к 2020 г. примерно до 200 000 т в год. Поэтому потребуются новые проекты, чтобы избежать его дефицита в долгосрочной перспективе. «Без кобальта из ДРК вообще нельзя будет говорить о производстве электромобилей – вот насколько рынку нужно больше этого металла», – утверждает Саймон Мурс из Benchmark Mineral Intelligence.
Литий хоть и более доступен, но в ближайшие годы тоже может возникнуть нехватка его предложения. Спрос на литий вырастет в четыре раза до 779 000 т к 2025 г., по оценкам Goldman Sachs. Но удовлетворить его будет трудно, так как «многие проекты, которые были анонсированы с фанфарами, не смогли привлечь достаточного финансирования», отмечают аналитики банка. Литий сейчас добывается в горах Австралии и пустынях Южной Америки. Но не все его запасы пригодны для производства аккумуляторов, отмечает гендиректор Neo Lithium Вальдо Перес. Например, у Боливии огромные запасы лития, но они содержат много примесей магния. Поэтому «Боливия определенно не подходит», говорит Перес.
Поэтому «Боливия определенно не подходит», говорит Перес.
Главную неопределенность для сырьевых рынков представляет то, какой будет технология выпуска аккумуляторов. Их производители сокращают использование кобальта из-за высокой цены и проблем с поставками. В сентябре британская Johnson Matthey заявила, что разработала более эффективные аккумуляторы с использованием лития и никеля и меньшим содержанием кобальта. Как отмечает инвестбанк Liberum, никель помогает повысить мощность аккумуляторов и при этом стоит в шесть раз дешевле кобальта, а его предложение примерно в 20 раз выше. По прогнозам Мурса из Benchmark Mineral Intelligence, спрос на никель вырастет с 75 000 т в 2016 г. до 400 000 т к 2025 г.
В долгосрочной перспективе производители аккумуляторов намерены изменить их конструкцию. Британская Dyson планирует выйти на рынок электромобилей к 2020 г. с помощью твердотельных аккумуляторов, которые должны хранить и отдавать больше энергии. Toyota тоже стремится начать использовать твердотельные аккумуляторы в своих автомобилях в начале 2020-х гг.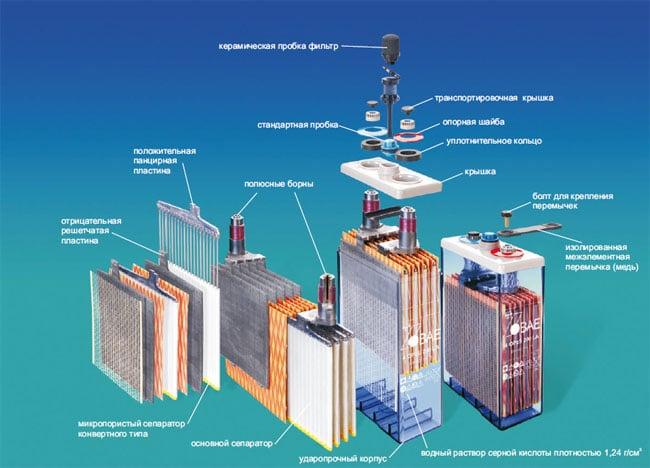 Они заменят аккумуляторы с жидким электролитом.
Они заменят аккумуляторы с жидким электролитом.
«Всем хочется в будущем иметь чудесные химические вещества, не связанные с этими редкими материалами, но сейчас они недоступны, – говорит Стивен Айриш из британской Hyperdrive, занимающейся аккумуляторами. – Все задаются вопросом, произойдет ли революция в производстве аккумуляторов. Но на самом деле речь идет о серии постепенных улучшений».
Перевел Алексей Невельский
что это, значение, принцип работы
В автомобилях и мотоциклах аккумулятор используется для запуска двигателя электростартером. Он служит вспомогательным источником электроэнергии при заглушенном двигателе или в случаях, когда генератор на малых оборотах не справляется с нагрузкой.
Что такое аккумуляторная батарея
Аккумулятор — это перезаряжаемый источник электроэнергии, используемый в машинах и мотоциклах. В автомобилях используются свинцово-кислотные аккумуляторные батареи. Этот выбор обоснован тремя качествами:
- доступная цена;
- высокая удельная энергоемкость;
- низкое внутреннее сопротивление (большой пусковой ток).

Принцип действия АКБ (автомобильной кислотной батареи) основан на реакции свинца и его диоксида. При разряде электроэнергия вырабатывается за счет взаимодействия свинца с серной кислотой (образование сульфата). Во время заряда окисляется свинец анода и восстанавливается диоксид свинца на катоде.
Устройства состоят из последовательно соединенных секций («банок») напряжением 2 вольта. Напряжение зависит от сферы применения:
- 6-вольтовые АКБ применяются на легкой моторной технике;
- 12-вольтовые — на большинстве мотоциклов, автомобилей, грузовиков и автобусов с бензиновыми моторами;
- 24-вольтовые — на тяжелых дизельных грузовиках и автобусах, на специальной и армейской технике.
Какие бывают аккумуляторы. Виды аккумуляторов
Аккумуляторные батареи делятся на два типа:
- Пусковые, главное назначение первых — питание стартера двигателя. Они отличаются большим пусковым током, однако разрушаются при глубоком разряде и не могут долгое время выдавать большой ток.
 Такие АКБ устанавливаются на технику с двигателями внутреннего сгорания.
Такие АКБ устанавливаются на технику с двигателями внутреннего сгорания. - Тяговые, предназначенные для обеспечения ходовых двигателей электроэнергией. Они не могут выдать ток в сотни ампер, зато могут без вреда разряжаться «в ноль» — пластины не разрушаются при глубоком разряде. Более толстые прочные пластины кислотных тяговых АКБ увеличивают вес и стоимость устройств. Такие аккумы используются на электромобилях, погрузчиках и прочей технике с электродвигателями.
В зависимости от сплава состава пластин и электролита, автомобильные пусковые АКБ делятся на следующие типы:
- Сурьмянистые. Самая старая разновидность «аккумов», отличающаяся высоким содержанием сурьмы в свинцовых электродах (более 5%). Сурьма увеличивает прочность пластин, однако усиливает процесс электролиза — вода разлагается на кислород и водород. Такие аккумуляторы требуют постоянного контроля уровня содержимого банок и доливки дистиллированной воды.
- Малосурьмянистые. АКБ с небольшим содержанием сурьмы (до 5%) медленнее выкипают и не требуют частых проверок уровня электролита.
 Это позволило создать необслуживаемые батареи, которые практически не требуют вмешательства. В отличие от кальциевых и гелиевых батарей, малосурьмянистые менее требовательны к показателям напряжения бортовой сети. Если напряжение на генераторе превышает норму, АКБ не разрушаются и не теряет емкость.
Это позволило создать необслуживаемые батареи, которые практически не требуют вмешательства. В отличие от кальциевых и гелиевых батарей, малосурьмянистые менее требовательны к показателям напряжения бортовой сети. Если напряжение на генераторе превышает норму, АКБ не разрушаются и не теряет емкость. - Кальциевые. Более современные модели, в которых свинец пластин содержит кальций вместо сурьмы. Это позволило еще больше снизить интенсивность газовыделения и уменьшить саморазряд. Они хранятся дольше, однако теряют емкость при систематическом перезаряде и резких скачках напряжения бортовой сети. Поэтому для старых отечественных авто с ненадежным электрооборудованием актуальны малосурьмянистые аккумы.
- Гибридные. Малосурьмянистые аноды и кальциевые катоды таких устройств позволяют совместить положительные качества двух типов батарей. Они имеют средние характеристики: расход воды ниже, чем у сурьмянистых, устойчивость к перезаряду выше, чем у кальциевых.
- Гелевые и AGM.
 Электролит в них находится в связанном гелеобразном состоянии. Это исключает возможность утечки кислоты при повреждении или опрокидывании аккума. AGM-устройства заполнены пористым материалом, предотвращающим осыпание пластин. Высокая цена, резкое падение емкости при низкой температуре и уязвимость к большому току заряда делает их востребованными лишь на дорогих иномарках, оборудованных системами «стоп-старт».
Электролит в них находится в связанном гелеобразном состоянии. Это исключает возможность утечки кислоты при повреждении или опрокидывании аккума. AGM-устройства заполнены пористым материалом, предотвращающим осыпание пластин. Высокая цена, резкое падение емкости при низкой температуре и уязвимость к большому току заряда делает их востребованными лишь на дорогих иномарках, оборудованных системами «стоп-старт».
Отдельно стоит отметить два вида батарей, используемых на технике с электроприводом:
- Щелочные. Никель-железные и никель-кадмиевые аккумы со щелочью вместо кислоты отличаются устойчивостью к глубокому разряду и долговечностью. Однако они обладают высоким внутренним сопротивлением и не могут выдать ток, достаточный для работы стартера.
- Литий-ионные. Изделия отличаются высокой энергоемкостью и быстрым зарядом. Однако они дорого стоят, чувствительны к температуре и быстро теряют емкость. Их используют на электромобилях типа Tesla, Nissan Leaf.
Щелочные и литиевые батареи не применяются в качестве пусковых.
Из чего состоит аккумулятор автомобиля (конструкция аккумулятора)
12-вольтовая аккумуляторная батарея состоит из корпуса с отделениями для 6 ячеек. В ячейки помещены сборки из положительных и отрицательных электродов, разделенных сепараторами. Перемычки обеспечивают электрический контакт между анодами и катодами соседних банок. К крайнему катоду и аноду подключена отрицательная и положительная клеммы. Банки заполнены электролитом — водным раствором серной кислоты. Для его заливки и контроля уровня в крышке корпуса имеются пробки.
Основные характеристики автомобильного аккумулятора
При выборе аккума для машины следует обратить внимание на такие показатели:
- Емкость — количество электроэнергии, которую может отдать аккумулятор до момента полного разряда.
- Напряжение, которое должно соответствовать напряжению бортовой сети.
- Пусковой ток, определяющий эффективность работы аккумулятора.
- Полярность — расположение положительной и отрицательной клеммы.
 Если расположить АКБ лицевой частью к себе (стороной с клеммами), при прямой полярности плюс находится слева, при обратной — справа. В отечественных авто и большинстве иномарок предусмотрены аккумы с прямой полярностью.
Если расположить АКБ лицевой частью к себе (стороной с клеммами), при прямой полярности плюс находится слева, при обратной — справа. В отечественных авто и большинстве иномарок предусмотрены аккумы с прямой полярностью. - Габариты. Слишком большую или маленькую батарею не получится закрепить на штатном месте.
Следует учитывать тип АКБ. Для машин с системами «старт-стоп» нужно покупать гелевые и AGM-системы, а на более простые авто следует ставить кальциевые и гибридные.
Как устроен литий-ионный аккумулятор | Полезная информация | Cписок категорий | Блог
Берем два длинных листка: из графита и из оксида лития с кобальтом (LiCoO2). Смазываем их электролитом, прокладываем между ними тонкую перфорированную пластиковую пленку и сворачиваем рулончиком. Литий-ионный аккумулятор готов.Когда мы подаем на пластинки напряжение — на графит минус, а на оксид лития плюс — от молекул оксида отцепляются положительно заряженные ионы лития и перепрыгивают на углеродную пластинку.
 Так происходит зарядка аккумулятора.
Так происходит зарядка аккумулятора.Первый в мире серийный электрический спорткар Tesla Roadster, питается как раз от литий-ионных аккумуляторов. Принципиально они не отличаются от аккумулятора для шуруповерта, ноутбука или телефона.
Когда аккумулятор заряжен и вы решаете им воспользоваться, то все происходит наоборот: положительно заряженные ионы лития перепрыгивают обратно на оксид лития, в свое нормальное состояние. В полученной батарейке графитовая пластинка становится минусом, а оксид лития — плюсом.
Такие аккумуляторы обладают большой емкостью, у них нет эффекта памяти, они легкие и компактные.
Эффект памяти аккумулятора — в настоящий момент под эффектом памяти понимается обратимая потеря ёмкости, имеющая место в некоторых типах электрических аккумуляторов при нарушении рекомендованного режима зарядки, в частности, при подзарядке не полностью разрядившегося аккумулятора. Название связано с внешним проявлением эффекта: аккумулятор как будто «помнит», что в предыдущие циклы работы его ёмкость не была использована полностью, и при разряде отдаёт ток до «запомненной границы».
Но при неправильном использовании у них есть и минусы:
- При сильном нагревании аккумулятор может загореться.
- Если аккумулятор сядет ниже определенного критического уровня, то его больше никогда нельзя будет зарядить.
Поэтому такие аккумуляторы объединяют в батареи со встроенной электроникой, которая следит за температурой и режимами зарядки каждого отдельного аккумулятора.
Аккумуляторы для ИБП. Классификация
Содержание:
Аккумулятор ИБП — основная часть бесперебойника
Очень важной частью любого источника бесперебойного питания является аккумуляторная батарея. От технических характеристик аккумулятора для ИБП зависят все основные параметры бесперебойника. Именно аккумулятор ИБП определяет в конечном счете и мощность источника и длительность резерва бесперебойника. Вот почему необходимо грамотно подойти к вопросу выбора аккумулятора для источника бесперебойного питания.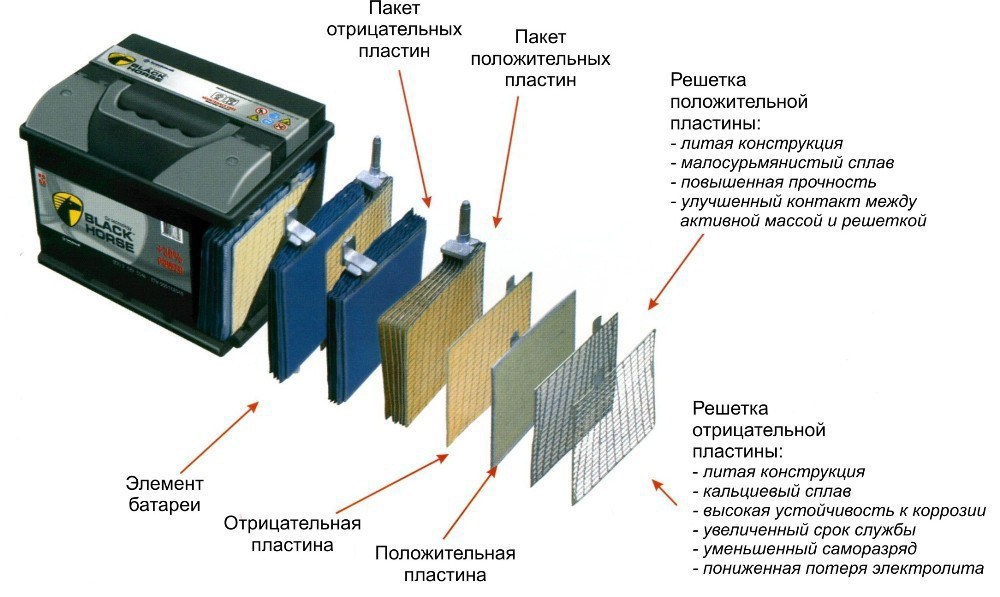
Аккумуляторы для бесперебойников. Классификация по конструктивному типу
В наше время в мире выпускаются аккумуляторы различных типов. Вот далеко не полный список: свинцово-кислотные, медно-литиевые, никель-кадмиевые, никель-металлогидридные, железо-никелевые, серно-натриевые, серебряно-цинковые, серебряно-кадмиевые, литий-ионные, литий-полимерные, никель-водородные, марганцево-цинковые. Все типы аккумуляторных батарей имеют различную конструкцию, различные свойства и различные цены.
Свинцово-кислотные аккумуляторы для ИБП
Свинцово-кислотные (с английского Sealed Lead Acid) аккумуляторные батареи получили наибольшее распространение. К положительным свойствам относятся: низкая стоимость, низкий саморазряд, высокая надежность, стабильность напряжения, работа в широком диапазоне температур, длительность циклов работы, возможность совершать до тысячи циклов заряда / разряда.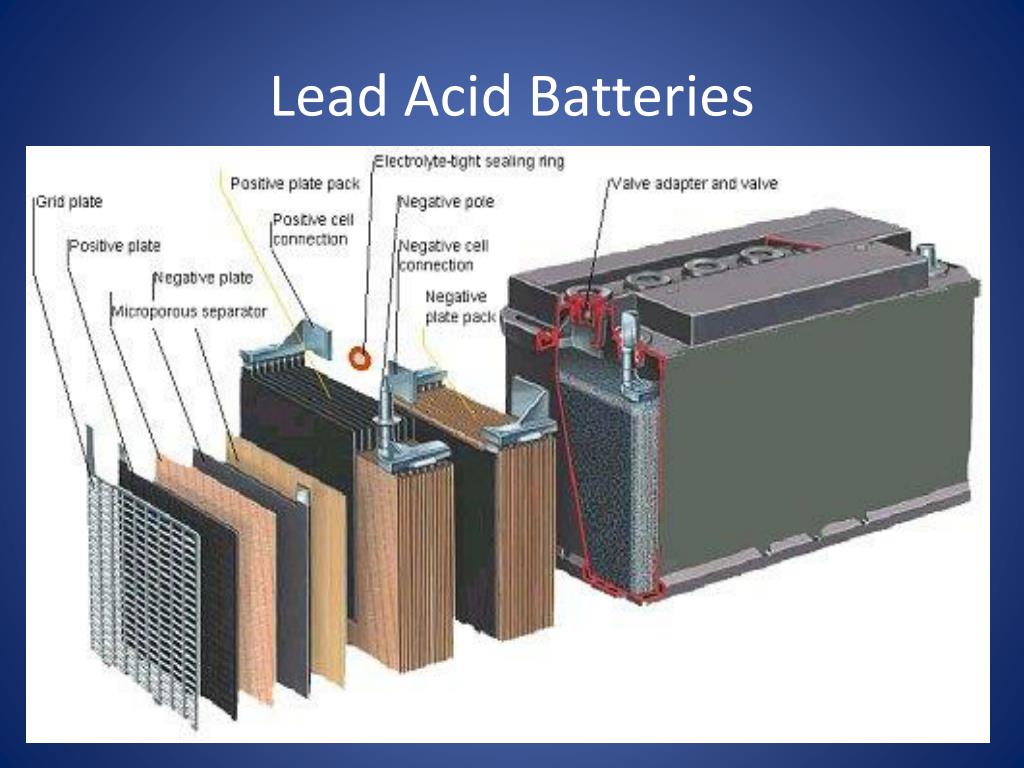
Никелево-кадмиевые аккумуляторы для ИБП
Никелево-кадмиевые (Ni-Cd) аккумуляторные батареи получили большую известность в последние годы благодаря маленькому весу и размерам широко применяются в различных электронных устройствах. К положительным свойствам относятся: высокая энергетическая плотность, возможность осуществления до 1500 перезарядок, низкий саморазряд (менее 20 % в месяц), не дорогая цена, высокая надежность, простота в эксплуатации, хорошая стойкость к перепадам температур. К отрицательным свойствам относятся: наличие «эффекта памяти», постепенное уменьшение ёмкости АКБ, использует высокотоксичное вещество, высокая стоимость переработки и утилизации.
Никелево-металлогидридные аккумуляторы для ИБП
Никелево-металлогидридные (Ni-MH) аккумуляторные батареи известны довольно давно и обладают рядом улучшенных характеристик, но они не получили большого распространения, прежде всего из-за сложностей в эксплуатации.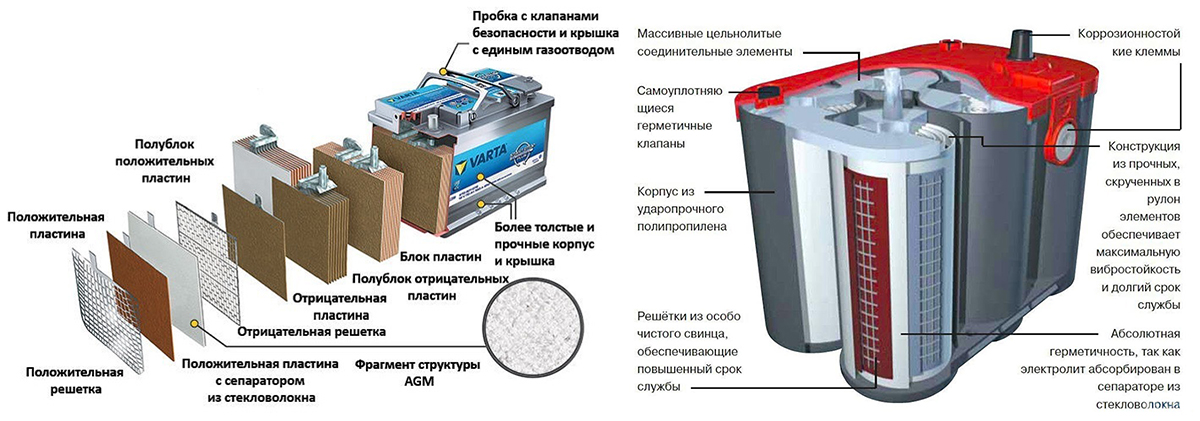 К положительным свойствам относятся: высокая удельная ёмкость, стабильная работа, большая энергетическая плотность, не снижает уровень ёмкости. К отрицательным свойствам относятся: малое число циклов заряда / разряда, высокая цена батареи, более узкий температурный режим работы, малая нагрузочная способность, не переносит глубоких разрядов, высокий уровень саморазряда, сложность процесса зарядки, большие расходы на эксплуатацию.
К положительным свойствам относятся: высокая удельная ёмкость, стабильная работа, большая энергетическая плотность, не снижает уровень ёмкости. К отрицательным свойствам относятся: малое число циклов заряда / разряда, высокая цена батареи, более узкий температурный режим работы, малая нагрузочная способность, не переносит глубоких разрядов, высокий уровень саморазряда, сложность процесса зарядки, большие расходы на эксплуатацию.
Литиево-ионные аккумуляторы для ИБП
Литиево-ионные (Li-Ion) аккумуляторные батареи были изобретены ещё в первой половине 20 века, однако их массовое производство началось только в 90-х годах. Сегодня они являются наиболее перспективными для использования в электронных устройствах. Такие батареи имеют большую удельную ёмкость и могут обеспечить мощного потребителя при малом собственном весе и размере. К положительным свойствам относятся: высокая надёжность работы, большая энергетическая плотность (около 100 Вт*ч/кг), очень маленькая скорость саморазряда (около пяти процентов в месяц), АКБ не теряет ёмкости в процессе работы, низкая стоимость обслуживания. К отрицательным свойствам относятся: высокая цена, не достаточно широкий диапазон температур работы, АКБ необходимо хранить в заряженном виде, есть эффект старения, необходимо использовать специальные зарядные устройства.
К отрицательным свойствам относятся: высокая цена, не достаточно широкий диапазон температур работы, АКБ необходимо хранить в заряженном виде, есть эффект старения, необходимо использовать специальные зарядные устройства.
В настоящее время наибольшее распространение получили обычные свинцово-кислотные аккумуляторы для ИБП. Основные причины — высокая надёжность аккумуляторных батарей, низкая стоимость приобретения, простота в обслуживании, работоспособность в тяжелых климатических условиях, возможность многократных процедур заряда.
Аккумуляторы для бесперебойников. Классификация по типу электролита
По типу используемого электролита все аккумуляторные батареи можно разделить на три основные группы: АКБ с жидким электролитом, АКБ по технологии GEL, АКБ по технологии AGM. Рассмотрим основные характеристики этих типов аккумуляторов.
Аккумуляторы для источника бесперебойного питания с жидким электролитом
Аккумуляторные батареи с жидким электролитом имеют наибольшее распространение. Эта технология включает использование раствора серной кислоты в качестве электролита. К такому типу относятся обычные автомобильные АКБ. Основной их недостаток состоит в том, что они не герметичны. В процессе работы такие батареи выделяют водород и пары серной кислоты, что негативно сказывается на их экологичности. Негерметичные аккумуляторы требуют сложного обслуживания, специального помещения для проведения работ по зарядке и обслуживанию. К положительным свойствам следует отнести низкую стоимость приобретения батареи. Такие аккумуляторы редко используются для источников бесперебойного питания, однако могут быть применены в случае внешнего подключения АКБ и наличия специального не жилого помещения.
Эта технология включает использование раствора серной кислоты в качестве электролита. К такому типу относятся обычные автомобильные АКБ. Основной их недостаток состоит в том, что они не герметичны. В процессе работы такие батареи выделяют водород и пары серной кислоты, что негативно сказывается на их экологичности. Негерметичные аккумуляторы требуют сложного обслуживания, специального помещения для проведения работ по зарядке и обслуживанию. К положительным свойствам следует отнести низкую стоимость приобретения батареи. Такие аккумуляторы редко используются для источников бесперебойного питания, однако могут быть применены в случае внешнего подключения АКБ и наличия специального не жилого помещения.
Аккумуляторы GEL для источника бесперебойного питания
Аккумуляторы GEL (гелиевые аккумуляторы) производятся по технологии GEL-Electrolite. Для получения нужного желеобразного состояния в состав электролита АКБ добавляют специальный загуститель.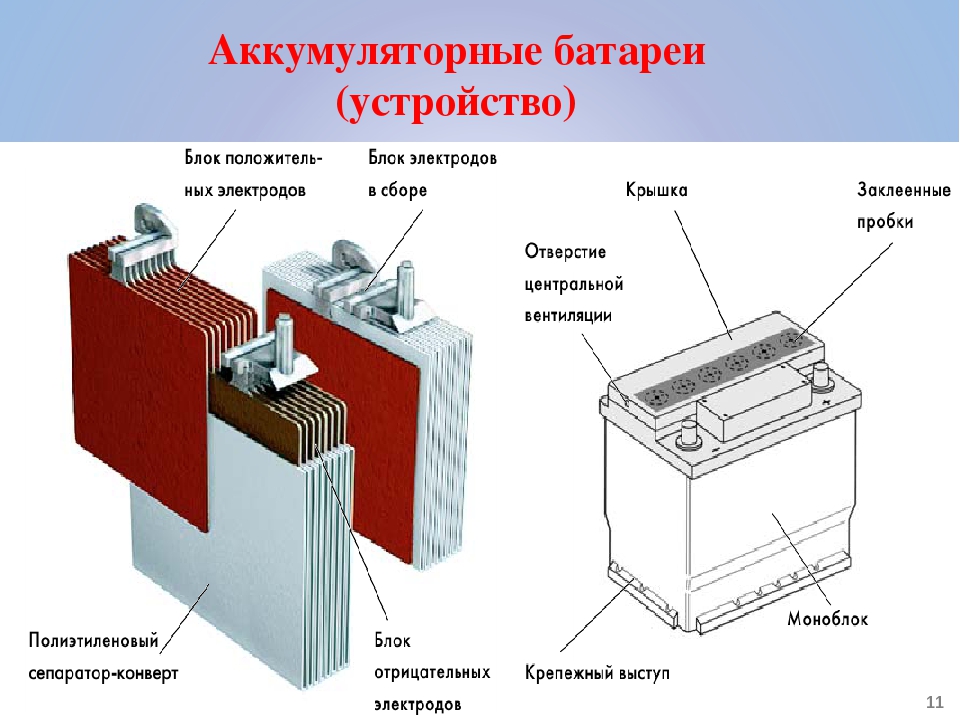 Аккумуляторы, созданные по этой технологии, не имеют выделения газов. Поэтому они изготавливаются герметичными. Герметичные аккумуляторы для ИБП безопасны и не требуют специального обслуживания. GEL АКБ имеют высокую надёжность, работоспособны в широком диапазоне температур, имеют высокую ёмкость и длительный срок эксплуатации. Однако их стоимость более высокая, чем у негерметичных АКБ. Также необходимо не допускать глубокого разряда таких батарей.
Аккумуляторы, созданные по этой технологии, не имеют выделения газов. Поэтому они изготавливаются герметичными. Герметичные аккумуляторы для ИБП безопасны и не требуют специального обслуживания. GEL АКБ имеют высокую надёжность, работоспособны в широком диапазоне температур, имеют высокую ёмкость и длительный срок эксплуатации. Однако их стоимость более высокая, чем у негерметичных АКБ. Также необходимо не допускать глубокого разряда таких батарей.
Аккумуляторы AGM для источника бесперебойного питания
Аккумуляторы по технологии AGM (Absorptive Glass Mat) являются самыми современными. По сути они являются модернизацией АКБ типа GEL. В качестве электролита в таких батареях используют жидкий электролит, абсорбированный специальными пористыми волокнами. Такая технология позволяет делать батареи герметичными. При их работе не выделяются вредные пары. В то же время электрическое сопротивление таких АКБ ниже, что существенно улучшает показатели. В производстве источников бесперебойного питания именно аккумуляторы по технологии AGM получили большое распространение. Такие АКБ имеет ряд положительных свойств: высокая надёжность работы, простое обслуживание, большая эпикритическая ёмкость, низкая стоимость приобретения и низкая стоимость обслуживания, большой срок службы.
В производстве источников бесперебойного питания именно аккумуляторы по технологии AGM получили большое распространение. Такие АКБ имеет ряд положительных свойств: высокая надёжность работы, простое обслуживание, большая эпикритическая ёмкость, низкая стоимость приобретения и низкая стоимость обслуживания, большой срок службы.
Купить аккумуляторы для ИБП в Ростове-на-Дону, Москве, Санкт-Петербурге, Новосибирске в магазинах СКАТ
Получить необходимые консультации специалистов, подобрать нужный аккумулятор по размерам и техническим характеристикам помогут специалисты сети магазинов СКАТ. Большой выбор различных моделей аккумуляторов для бесперебойников вы найдете в фирменных салонах в городах: Москва, Ростов-на-Дону, Санкт-Петербург, Новосибирск.
Читайте также:
Аккумуляторные батареи. Виды и устройство. Применение
АКБ или аккумуляторные батареи – это оборудование, которое состоит из нескольких аккумуляторов.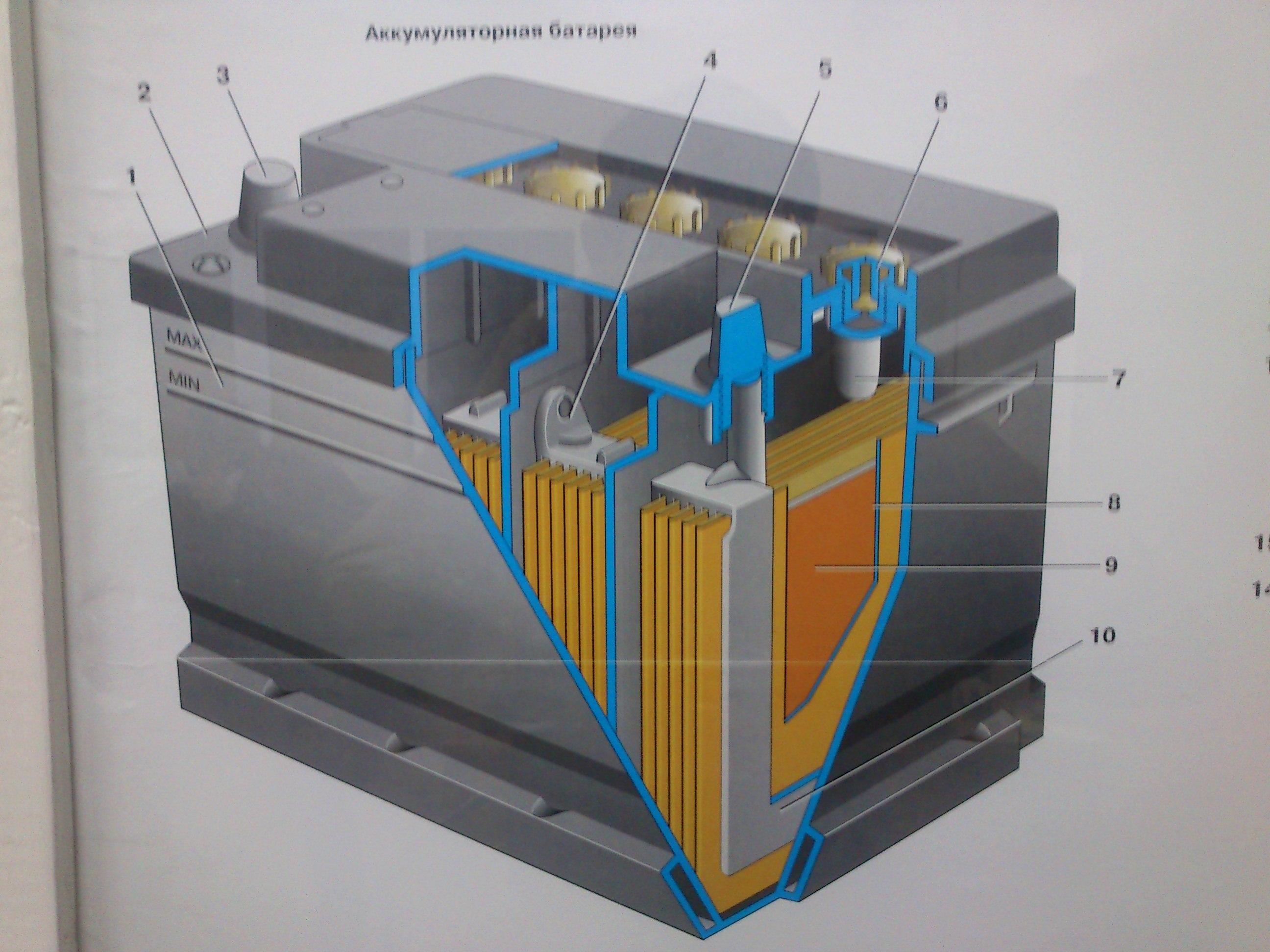 Оно может накапливать, хранить и расходовать энергию. Благодаря обратимости химических процессов, происходящих внутри аккумулятора, такие устройства могут заряжаться и разряжаться многократно.
Оно может накапливать, хранить и расходовать энергию. Благодаря обратимости химических процессов, происходящих внутри аккумулятора, такие устройства могут заряжаться и разряжаться многократно.
Сфера применения аккумуляторов весьма обширна. Они применяются в автомобилях и различной бытовой технике, например, в пультах ДУ и ноутбуках. Но также и в качестве резервных источников питания в медицинской сфере, производстве, космической отрасли, дата-центрах.
Виды и типы АКБ
Сегодня производят около 30 типов аккумуляторов. Такое большое количество обуславливается возможностью применять в качестве электродов и электролитов различные химические элементы. Именно от материала электрода и состава электролита зависят все характеристики аккумулятора.
Мы не будем приводить все типы, а лишь дадим небольшую таблицу с описанием наиболее распространенных:
Устройство1 — Отрицательный электрод
2 — Разделительный слой
3 — Положительные электроды
4 — Отрицательный контакт
5 — Предохранительный клапан
6 — Положительные электроды
7 — Положительный контакт
Аккумуляторные батареи состоят из нескольких банок аккумуляторов, соединенных либо параллельно, либо последовательно.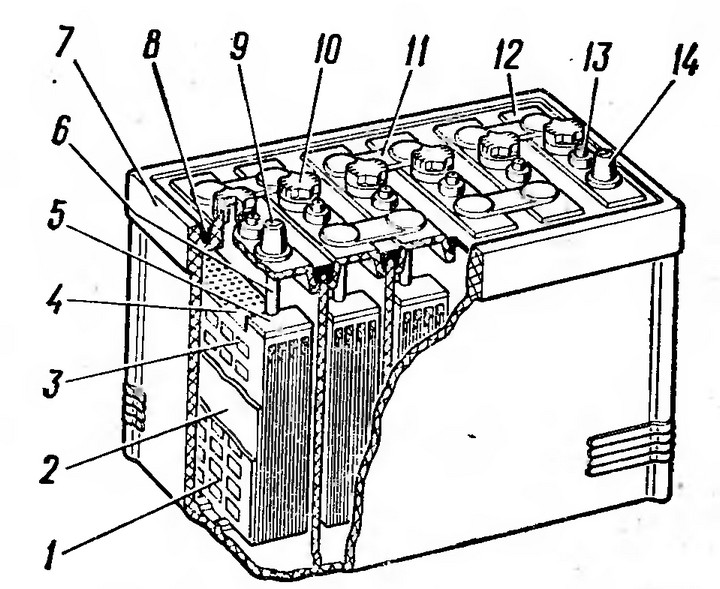 Последовательное соединение применяют в целях увеличения напряжения, а параллельное для увеличения силы тока.
Последовательное соединение применяют в целях увеличения напряжения, а параллельное для увеличения силы тока.
Каждый из отдельно взятого аккумулятора в АКБ состоит из двух электродов и электролита, помещенных в корпус из специального материала.
Электрод с отрицательным зарядом – анод, с положительным зарядом – катод. Анод содержит восстановитель, катод – окислитель. Внутри корпуса аккумулятора стоит разделительная пластина, которая не позволяет электродам замыкаться.
Электролит – водный раствор, в который погружены оба электрода.
При разрядке аккумулятора восстановитель анода начинает окисляться и выделяются электроны. Электроны затем попадают в электролит и оттуда движутся к катоду, при этом создавая разрядный ток. Попадая в катод электроны восстанавливают его окислитель. Простыми словами можно описать процесс так: электроны идут от отрицательного электрода к положительному и создают разрядный ток.
При зарядке аккумулятора электроды меняются своим химическим составом и происходит обратная реакция. Электроны здесь двигаются от положительного анода к отрицательному катоду.
Электроны здесь двигаются от положительного анода к отрицательному катоду.
Разработан Гастоном Планте в 19 веке. Эти аккумуляторные батареи сегодня наиболее актуальны благодаря дешевизне и универсальности. Сфера их применения обширна ввиду большого количества разновидностей этого типа. В качестве отрицательно заряженных электродов здесь используется оксид свинца. Положительные электроды выполняются из свинца. Электролит – серная кислота.
У свинцовых-кислотных батарей есть следующие разновидности:
- LA – аккумуляторы с напряжением 6 или 12 Вольт. Традиционное устройство для осуществления запуска двигателей автомобилей. Требуют постоянного обслуживания и вентиляции.
- VRLA – напряжением 2, 4, 6 или 12 Вольт. Клапанно-регулируемая свинцово-кислотная аккумуляторная батарея. Как видно из названия этот АКБ укомплектован разгрузочным клапаном.
 Его роль – минимизировать выделение газа и расход воды. Такие батареи можно устанавливать в жилых помещениях.
Его роль – минимизировать выделение газа и расход воды. Такие батареи можно устанавливать в жилых помещениях. - AGM VRLA – как и предыдущий тип оснащен клапаном, но имеет совсем другие свойства. В аккумуляторах, сделанных по технологии AGM роль сепаратора играет стекловолокно. Его микропоры пропитаны жидким электролитом. Такие АКБ не требуют обслуживания и устойчивы к вибрациям.
- GEL VRLA – подвид свинцово-кислотных аккумуляторов с гелеобразным электролитом. Благодаря этому увеличен их ресурс заряда/разряда. Не требуют обслуживания.
- OPzV – герметичные аккумуляторы используемые в области телекоммуникации и для аварийного освещения. Электролит, как и в предыдущем случае гелевый. В электродах содержится кальций, благодаря которому срок службы такого типа батарей – 20 лет.
- OPzS – катод таких аккумуляторов имеет трубчатую структуру. Это существенно повышает циклический ресурс этого типа батарей.
 Служит также около 20 лет. Выпускается в виде АКБ с напряжением от 2 до 125 В.
Служит также около 20 лет. Выпускается в виде АКБ с напряжением от 2 до 125 В.
Был впервые выпущен Sony в 1991 году и с тех пор активно применяется в бытовой технике, электронных устройствах. Практически все мобильные телефоны, ноутбуки, фотоаппараты и видеокамеры оснащены таким видом батарей. Роль катода здесь играет литий-ферро-фосфатная пластина. Отрицательный анод – каменноугольный кокс. Положительный ион лития переносит заряд в таких батареях. Он может проникать в кристаллическую решетку других материй и образовывать с ними химическую связь. Преимуществом этого типа является высокая энергоемкость, низкий саморазряд и отсутствие нужды в обслуживании.
Литий-ионные аккумуляторные батареи также, как и их свинцовые аналоги имеют большое количество подтипов. В данном случае подтипы отличаются между собой составом катода и анода. Напряжение литий-ионных аккумуляторов варьируется в пределах от 2,4 до 3,7 В.
Одним из самых известных подтипов является литий-полимерные аккумуляторные батареи.
 Они появились сравнительно недавно и быстро завоевал популярность. Она обусловлена тем, что в литий-полимерных батареях используется твердый полимерный электролит. Это позволяет создавать батареи любой формы. При этом стоимость этих батарей всего лишь на 15% выше обычных литий-ионных.
Они появились сравнительно недавно и быстро завоевал популярность. Она обусловлена тем, что в литий-полимерных батареях используется твердый полимерный электролит. Это позволяет создавать батареи любой формы. При этом стоимость этих батарей всего лишь на 15% выше обычных литий-ионных.Похожие темы:
Создан аккумулятор, способный работать без подзарядки сотни лет
| ПоделитьсяВ Японии разработан аккумулятор на основе синтетических алмазов и радиоактивных изотопов. Одного его заряда хватает на сотни лет, и создатели предлагают использовать его в мощных буровых установках и космическом оборудовании. Но такие АКБ еще не могут похвастаться высокой удельной мощностью, и о серийном их производстве разработчики пока не задумываются.
«Бриллиантовые» японские аккумуляторы
Специалисты Национального института материаловедения Японии (National Institute of Materials Science, NIMS) разработали аккумулятор, работающий на одном заряде сотни лет. По информации Nikkei Asian Review, такой элемент питания состоит из трех основных элементов, два из которых радиоактивные.
Основной компонент нового японского аккумулятора – это алмаз, но не натуральный, добываемый в карьерах, а синтетический. Такие алмазы создаются в лабораторных условиях, имеют параметры, схожие с природными, но стоят в десятки раз дешевле, что позволяет широко применять их в различных областях.
Два других компонента – это изотопы углерода и никеля с длительным периодом полураспада. Так, для углерода-14 он составляет 5700 лет, а для никеля-63 – 100 лет. Использование обоих материалов и позволяет батарее работать сотнями лет.
Принцип действия
Синтетический алмаз в батарее, предложенной японскими учеными, используется в качестве электродов. Этот материал начинает вырабатывать электричество под воздействием бета-излучения от изотопов углерода и никеля, а чтобы защитить окружающую среду от радиоактивного загрязнения, батарея имеет металлическую защитную оболочку, выполненную из алюминия или другого металла. Батареи подобного плана называют «бета-гальваническими».
Этот материал начинает вырабатывать электричество под воздействием бета-излучения от изотопов углерода и никеля, а чтобы защитить окружающую среду от радиоактивного загрязнения, батарея имеет металлическую защитную оболочку, выполненную из алюминия или другого металла. Батареи подобного плана называют «бета-гальваническими».
Прототип своей батареи японцы демонстрировать не стали
Ученые разработали рабочий прототип такого аккумулятора, но до серийного производства нового типа АКБ пока еще очень далеко, поскольку им еще нужно решить проблему низкой удельной мощности, генерируемой их изобретением. На момент публикации материала она измерялась даже не в милливаттах – созданная в NIMS батарея вырабатывала лишь 1 микроватт мощности, то есть одну миллионную ватта.
Повышенная экологичность
Недостаточная удельная мощность – главный недостаток аккумулятора, созданного в стенах NIMS, тогда как основных достоинств у него два. Первое – это способность питать энергией потребителя в течение сотен лет, а второе – это возможность создавать такие АКБ из отработанных стержней ядерных реакторов.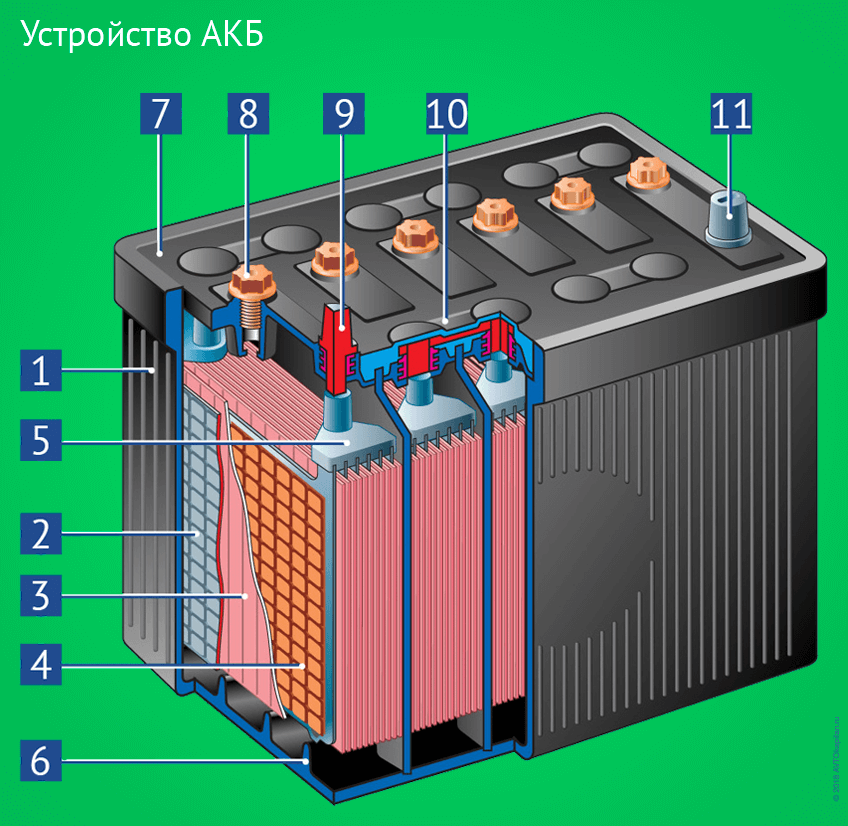
На поверхности таких графитовых стержней в изобилии присутствует углерод-14 – тот самый изотоп, который японцы предлагают использовать в своей батарее. Этот углерод в больших количествах может быть получен при демонтаже отработанных стержней, и над этим вопросом с 2020 г. работают специалисты Управления по атомной энергии и Бристольского университета Великобритании. Конкретные планы по производству сырья для алмазных батарей из отработанных графитовых стержней они пока не озвучивают.
Сферы применения
В настоящее время человечество активно использует сравнительно небольшие ядерные источники энергии. Например, такие источники на основе плутония применяются в космических аппаратах, вырабатывая относительно большое количество электроэнергии.
Стратегии ИБ всегда игнорировали безопасность данных. Больше этого делать нельзя
БезопасностьБатареи на основе электродов из синтетических алмазов с конструкцией, разработанной в NIMS, пока не способны вырабатывать столько же электричества, но зато обладают высокой термостойкостью и имеют более простую конструкцию.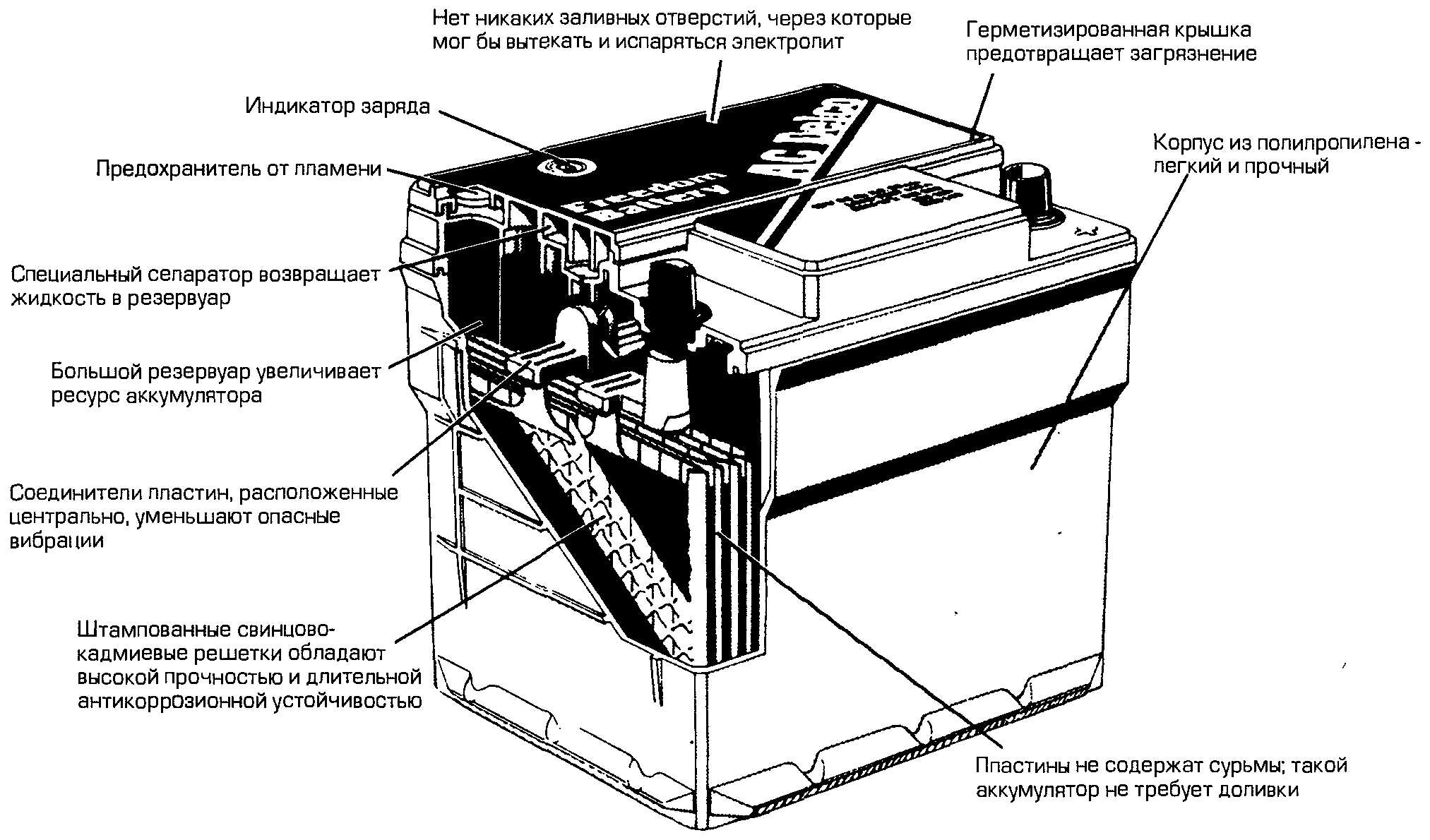 «Они могут работать даже при высоких температурах, и их можно использовать, в частности, в космическом оборудовании и машинах для разведки полезных ископаемых», — сказал Сатоши Коидзуми (Satoshi Koizumi), один из разработчиков алмазной батареи и сотрудник NIMS.
«Они могут работать даже при высоких температурах, и их можно использовать, в частности, в космическом оборудовании и машинах для разведки полезных ископаемых», — сказал Сатоши Коидзуми (Satoshi Koizumi), один из разработчиков алмазной батареи и сотрудник NIMS.
Алмазные аккумуляторы наоборот
Пока японские ученые экспериментируют с аккумуляторами на алмазных электродах в радиоактивной среде, их конкуренты из американской компании Nano Diamond Battery разрабатывают АКБ на искусственных алмазах, работающую по прямо противоположному принципу. В августе 2020 г. они рассказали, что создают элемент питания, в котором тоже используются изотопы, но их вырабатывает радиоактивный сердечник, тогда как синтетический алмаз выступает в качестве оболочки, защищающей окружающую среду от вредного радиоактивного излучения.
Форму батарее Nano Diamond Battery можно придать любую
Сердечник, по словам представителей Nano Diamond Battery, они планируют изготавливать из переработанных ядерных отходов, но не уточняют, из каких именно. Батареи, разработанные ими, могут быть выполнены в любом из современных форматов – АА, 18650, CR2032 и др., а срок их службы может достигать 28 тыс. лет. Специалисты компании провели ряд лабораторных испытаний таких АКБ, и, по их мнению, первые их версии, пригодные для повседневного использования, могут появиться в течение двух лет.
Батареи, разработанные ими, могут быть выполнены в любом из современных форматов – АА, 18650, CR2032 и др., а срок их службы может достигать 28 тыс. лет. Специалисты компании провели ряд лабораторных испытаний таких АКБ, и, по их мнению, первые их версии, пригодные для повседневного использования, могут появиться в течение двух лет.
Россия не отстает
В России тоже работают над созданием бета-гальванического элемента питания, и его прототип еще в августе 2020 г. был разработан специалистами НИТУ «МИСиС». Его конструкция базируется на микроканальной 3D-структуре никелевого бета-гальванического элемента – здесь радиоактивный элемент наносится с двух сторон так называемого планарного p-n перехода, что позволяет упростить технологию изготовления элемента, а также контролировать обратный ток, который «крадет» мощность батареи. Особая микроканальная структура обеспечивает увеличение эффективной площади преобразования бета-излучения в 14 раз, что в результате дает общее увеличение тока.
Разработка НИТУ «МИСиС»
Российская батарейка может генерировать энергию в течение 20 лет. За счет оригинальной 3D-структуры бета-гальванического элемента ее размеры, по словам разработчиков, уменьшились втрое, удельная мощность повысилась в 10 раз, а себестоимость снизилась на 50%.
Батарейка может быть применена в нескольких функциональных режимах: в качестве аварийного источника питания и датчика температуры в устройствах, используемых при экстремальных температурах и в труднодоступных (или совсем не доступных) местах: в космосе, под водой, в высокогорных районах.
Как работают батареи? | Живая наука
Батарейки везде. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на то, что они широко используются в повседневной жизни людей, батареям часто не уделяют должного внимания. Подумайте об этом: вы действительно знаете, как работает аккумулятор? Не могли бы вы объяснить это кому-нибудь другому?
Вот краткое изложение научных данных об источниках энергии для смартфонов, электромобилей, кардиостимуляторов и многого другого.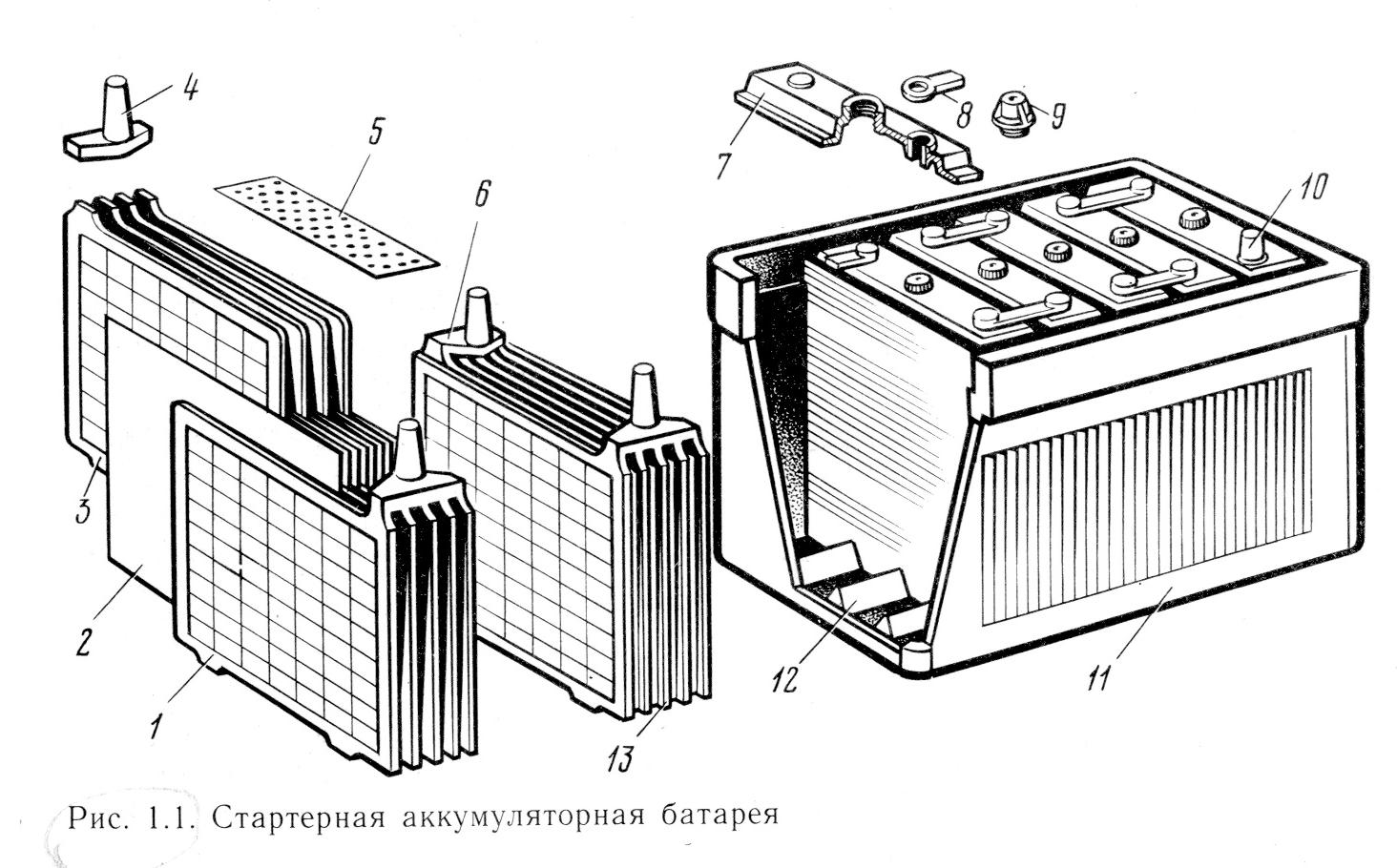 [Тест: электрические и газовые автомобили]
[Тест: электрические и газовые автомобили]
Анатомия аккумулятора
Большинство аккумуляторов состоят из трех основных частей: электродов, электролита и сепаратора, по словам Энн Мари Састри, соучредителя и генерального директора Sakti3, базирующейся в Мичигане. запуск аккумуляторных технологий.
В каждой батарее по два электрода. Оба изготовлены из токопроводящих материалов, но выполняют разные функции. Один электрод, известный как катод, подключается к положительному концу батареи и является местом, где электрический ток выходит (или электроны входят) в батарею во время разряда, когда батарея используется для питания чего-либо.Другой электрод, известный как анод, подключается к отрицательному полюсу батареи и является местом, где электрический ток входит (или электроны покидают) батарею во время разряда.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы.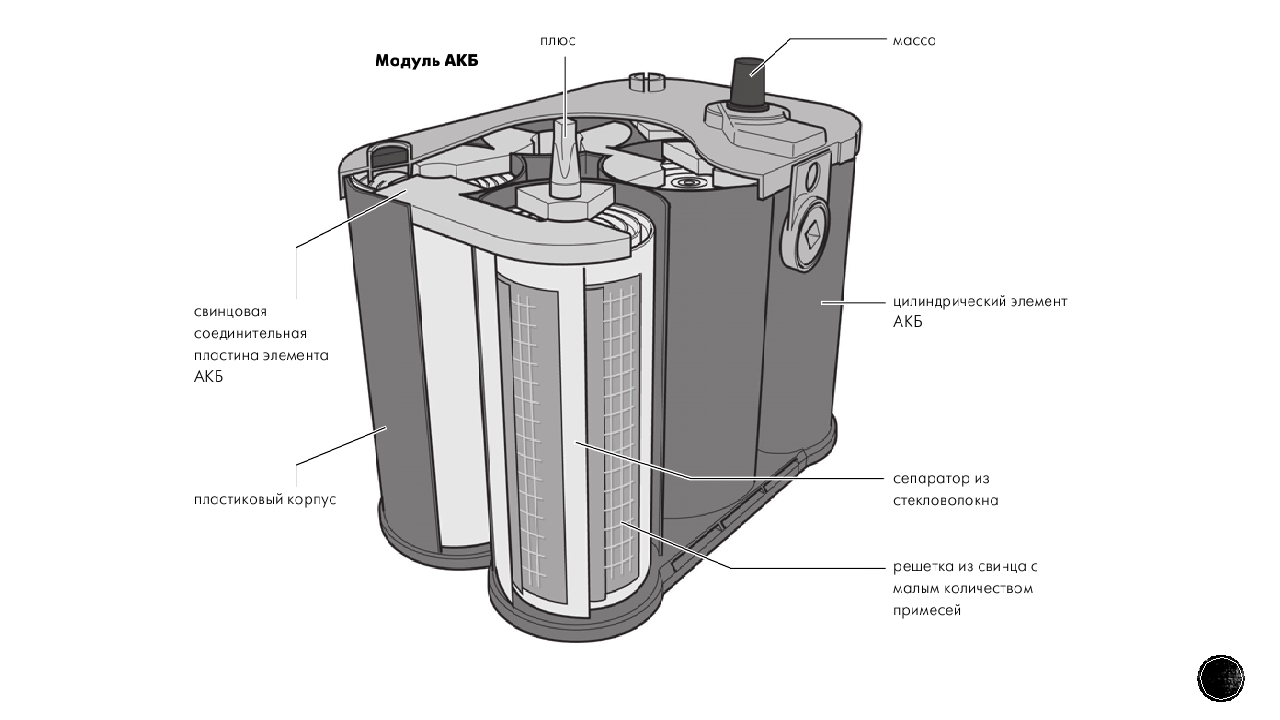 Ионы соединяются с материалами, из которых состоят электроды, производя химические реакции, которые позволяют батарее генерировать электрический ток.[Взгляд изнутри на работу батарей (инфографика)]
Ионы соединяются с материалами, из которых состоят электроды, производя химические реакции, которые позволяют батарее генерировать электрический ток.[Взгляд изнутри на работу батарей (инфографика)]
Последняя часть батареи, разделитель, довольно проста. Роль сепаратора состоит в том, чтобы удерживать анод и катод отдельно друг от друга внутри батареи. По словам Састри, без разделителя два электрода соприкоснутся, что приведет к короткому замыканию и нарушит нормальную работу батареи.
Как это работает
Чтобы представить себе, как работает батарейка, представьте, как вы вставляете щелочные батарейки, такие как двойные AA, в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь. Сохраненная в батарее химическая энергия преобразуется в электрическую, которая выходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но на противоположном конце от того места, где он выходил изначально.
Затем электрический ток снова входит в батарею, но на противоположном конце от того места, где он выходил изначально.
Все части батареи работают вместе, чтобы фонарик загорелся. Электроды в батарее содержат атомы определенных проводящих материалов. Например, в щелочной батарее анод обычно изготавливается из цинка, а диоксид марганца действует как катод. Электролит между этими электродами и внутри них содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, протекающих в электродах, вместе известна как окислительно-восстановительные (окислительно-восстановительные) реакции.В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к освобождению электронов от атомов электрода, — сказал Састри.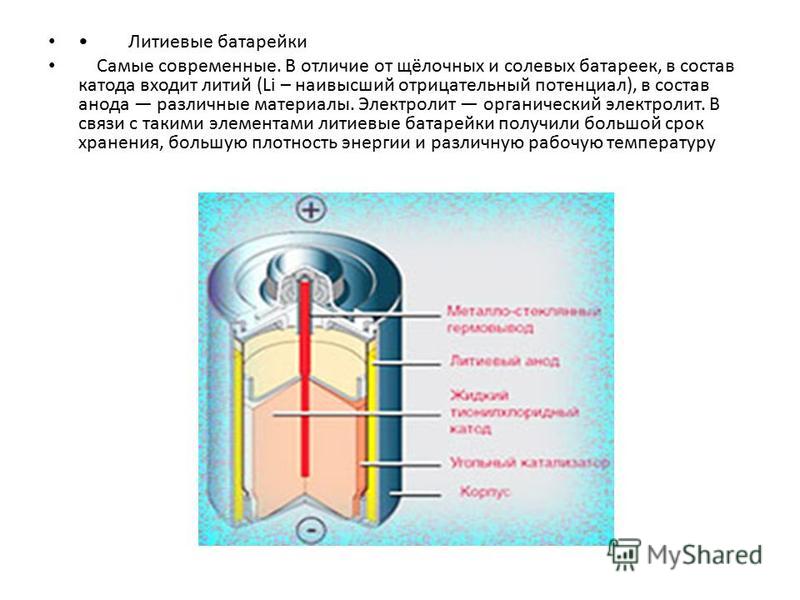
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате оба электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, поскольку электроны (которые заряжены отрицательно) поглощаются.Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду. Однако у них нет возможности попасть внутрь батареи, потому что разделитель не позволяет им сделать это.
Когда вы щелкаете выключателем на фонарике, все меняется. У электронов теперь есть путь к катоду. Но сначала они должны пройти через основание лампы фонарика. Схема замыкается, когда электрический ток снова входит в батарею через верхнюю часть батареи у катода.
Перезаряжаемые и неперезаряжаемые
Для первичных батарей, таких как батареи фонарика, реакции, питающие батарею, в конечном итоге прекратятся, а это означает, что электроны, обеспечивающие батарею ее зарядом, больше не будут создавать электрический ток. Когда это происходит, аккумулятор разряжен или «мертв», — сказал Састри.
Когда это происходит, аккумулятор разряжен или «мертв», — сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставили батарею производить энергию, не могут быть обращены вспять, объяснил Састри.Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, можно обратить вспять, подав в батарею электрическую энергию. Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Некоторые из наиболее распространенных используемых сегодня вторичных батарей — это литий-ионные (литий-ионные) батареи, от которых питается большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе.Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и беспроводные электроинструменты.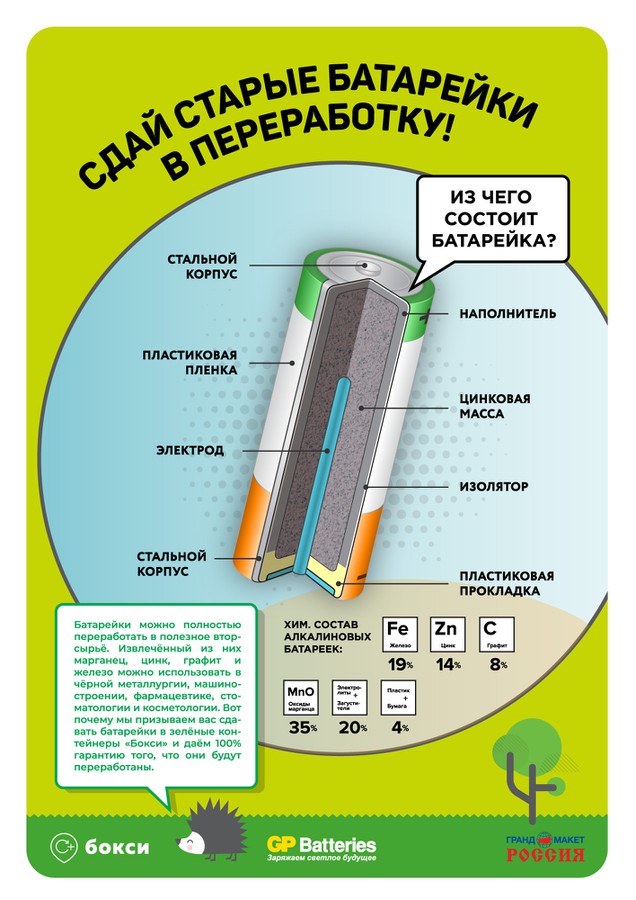 Свинцово-кислотные (Pb-кислотные) батареи обычно используются в автомобилях и других транспортных средствах для запуска, освещения и зажигания.
Свинцово-кислотные (Pb-кислотные) батареи обычно используются в автомобилях и других транспортных средствах для запуска, освещения и зажигания.
По словам Састри, все эти аккумуляторные батареи работают по одному и тому же принципу: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, и анод и катод возвращаются в исходное состояние.[10 лучших подрывных технологий]
Battery lingo
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при любом обсуждении батарей:
Напряжение : Когда дело доходит до батарей, напряжение — также известное как номинальное напряжение ячейки — описывает величину электрической силы или давления, при которой свободные электроны — переходите от положительного полюса батареи к отрицательному, — пояснил Састри.В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (с большей электрической силой).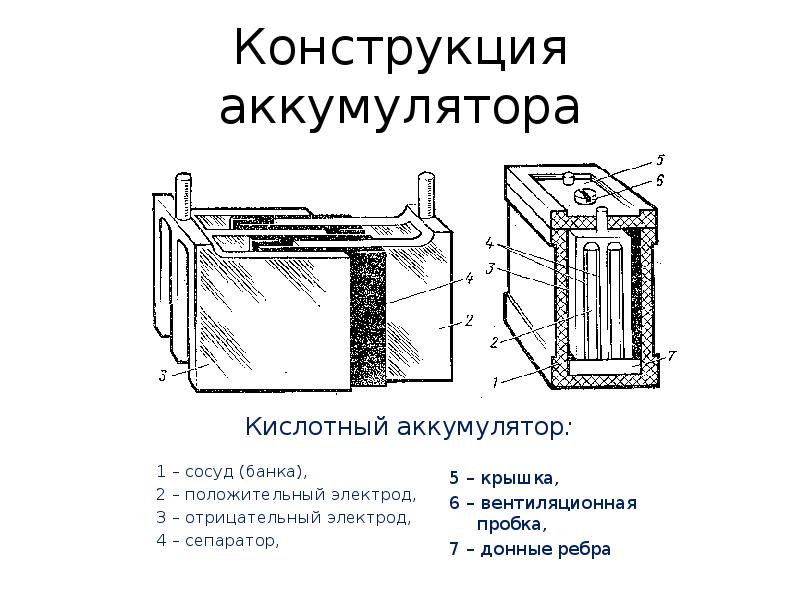 Батареи в фонарике обычно имеют напряжение 1,5 В. Однако, если фонарик использует две батареи последовательно, эти батареи или элементы имеют общее напряжение 3 вольта.
Батареи в фонарике обычно имеют напряжение 1,5 В. Однако, если фонарик использует две батареи последовательно, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные батареи, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольт. Но обычно в автомобильном аккумуляторе последовательно соединено шесть таких элементов, поэтому вы, вероятно, слышали, что такие аккумуляторы называются 12-вольтовыми батареями.
Литий-кобальто-оксидные батареи — наиболее распространенный тип литий-ионных батарей в бытовой электронике — имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер или ампер — это мера электрического тока или количества электронов, которые проходят через цепь в течение определенного периода времени.
Емкость : Емкость, или емкость элемента, измеряется в ампер-часах, то есть количество часов, в течение которых батарея может подавать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райса.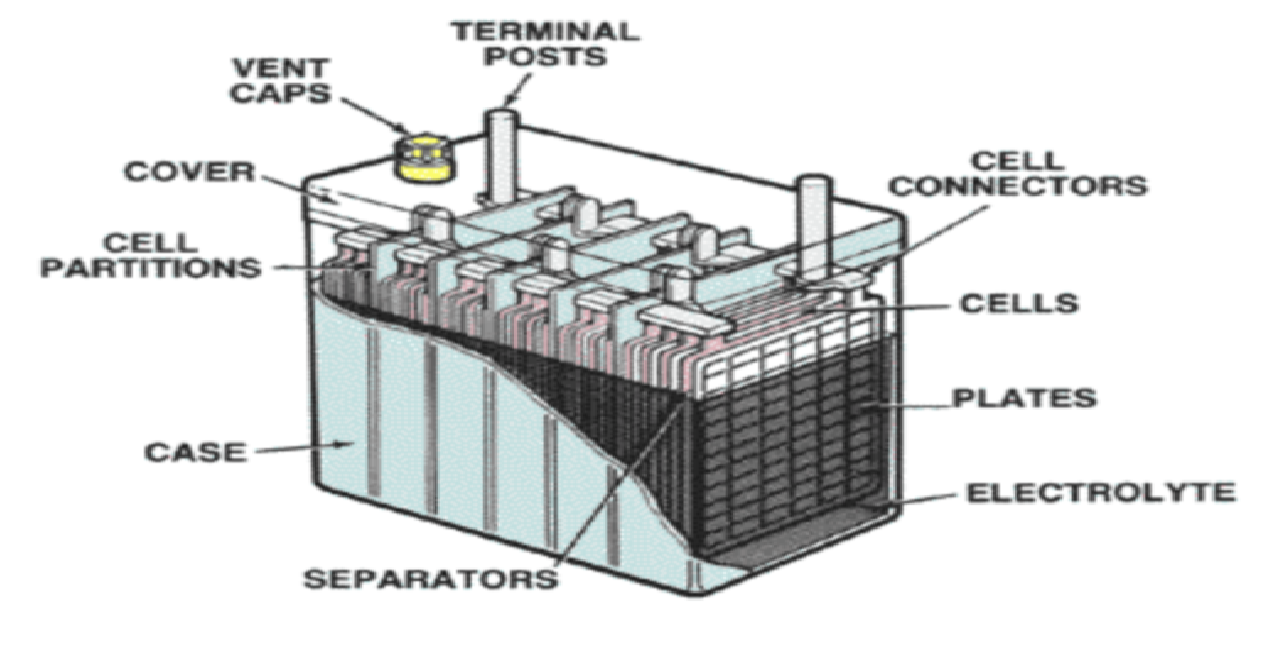 Кафедра электротехники и вычислительной техники университета.
Кафедра электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно обеспечивать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и будет считаться разряженной.
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей важна плотность мощности, потому что она показывает, насколько быстро автомобиль может разогнаться от 0 до 60 миль в час (97 км / ч).Инженеры постоянно пытаются найти способы уменьшить размеры батарей без уменьшения их удельной мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна отдавать батарея, деленное на объем или массу батареи, сказал Састри. Это число соответствует вещам, которые имеют большое влияние на пользователей, например, сколько времени вам нужно пройти до зарядки мобильного телефона или как далеко вы можете проехать на электромобиле, прежде чем остановиться, чтобы подключить его.
Follow Elizabeth Palermo @ techEpalermo .Подпишитесь на Live Science @livescience , Facebook и Google+ .
Дополнительные ресурсы
Что внутри батареи
Главная »Что внутри батареи?
Что внутри батареи?
Обычной батарее для выработки электричества необходимы 3 части:
- Анод — минус АКБ
- Катод — плюс аккумулятора
- Электролит — химическая паста, которая разделяет анод и катод и преобразует химическую энергию в электрическую
Внутри каждой батареи есть восстанавливаемые ресурсы, независимо от ее типа
Возьмем, к примеру, одноразовую щелочную батарею.Это неперезаряжаемые батареи, которые бывают AAA, AA, C, D, 9 вольт и различных размеров кнопочных элементов.
В среднем батарея на 25% состоит из стали (корпуса)..jpg) Знаете ли вы, что сталь можно перерабатывать бесконечно? Наш механический процесс позволяет восстановить 100% стали в каждой батарее для повторного использования.
Знаете ли вы, что сталь можно перерабатывать бесконечно? Наш механический процесс позволяет восстановить 100% стали в каждой батарее для повторного использования.
Аккумулятор на 60% состоит из таких материалов, как цинк (анод), марганец (катод) и калий. Все эти материалы — элементы земли. Эта комбинация материала на 100% восстанавливается и повторно используется в качестве питательного микроэлемента при производстве удобрений для выращивания кукурузы.
Остальные 15% по весу составляют бумага и пластик (этикетка и защитная крышка). Эти материалы отправляются на предприятие по переработке отходов для производства электроэнергии.
Утилизируя щелочные батареи в Raw Materials Company, вы можете быть уверены, что 100% каждой батареи используется повторно и никакие материалы не будут отправлены на свалку.
Вы живете в Онтарио, Канада?
Если да, то вы можете найти ближайший к вам магазин, который занимается переработкой батарей.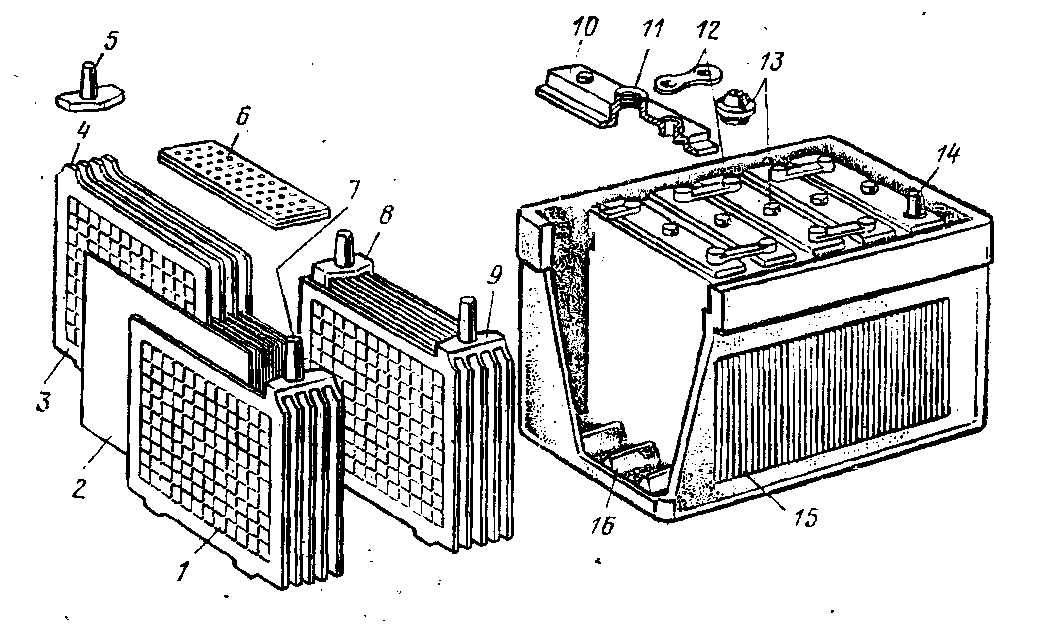 Просто введите свой почтовый индекс или название города в наш инструмент поиска. Если вы живете за пределами Онтарио, обратитесь в местный муниципалитет, чтобы найти ближайший пункт переработки.
Просто введите свой почтовый индекс или название города в наш инструмент поиска. Если вы живете за пределами Онтарио, обратитесь в местный муниципалитет, чтобы найти ближайший пункт переработки.
Спасибо
Мы получили ваше сообщение и вскоре ответим вам.
Быстрые ссылки
Для вашего удобства здесь приведены важные ссылки, связанные с этой страницей.
Знаете ли вы?
Свинцово-кислотные батареи — самые старые аккумуляторные батареи, которые все еще используются.В Канаде более 98% всех свинцово-кислотных аккумуляторов подлежат переработке.
Узнайте больше о нашей технологии и о том, как вместе мы превращаем отходы в ценный ресурс.
Что такое аккумулятор? — learn.sparkfun.com
Добавлено в избранное Любимый 22Введение
Батареи представляют собой совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи.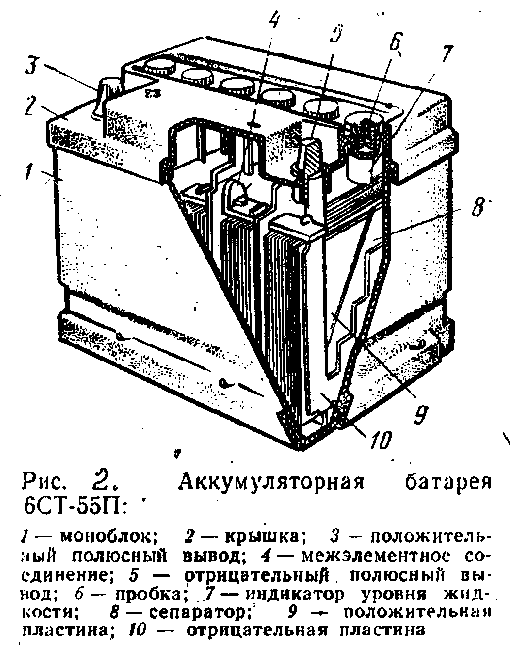 Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны проходить через цепь и возвращаться к катоду, где происходит другая химическая реакция.Когда материал в катоде или аноде расходуется или больше не может быть использован в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбросить после использования, известны как первичные батареи . Батареи, которые можно перезаряжать, называются вторичными батареями и .
Литий-полимерные батареи, например, можно заряжать
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную провернуть машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к розетке (как в старые добрые времена). Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218 Это ваши стандартные щелочные батарейки на 9 вольт от Rayovac. Даже не думайте пытаться перезарядить их. Используйте их с…
Даже не думайте пытаться перезарядить их. Используйте их с…
История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в случае артиллерийской батареи. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, связанных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку.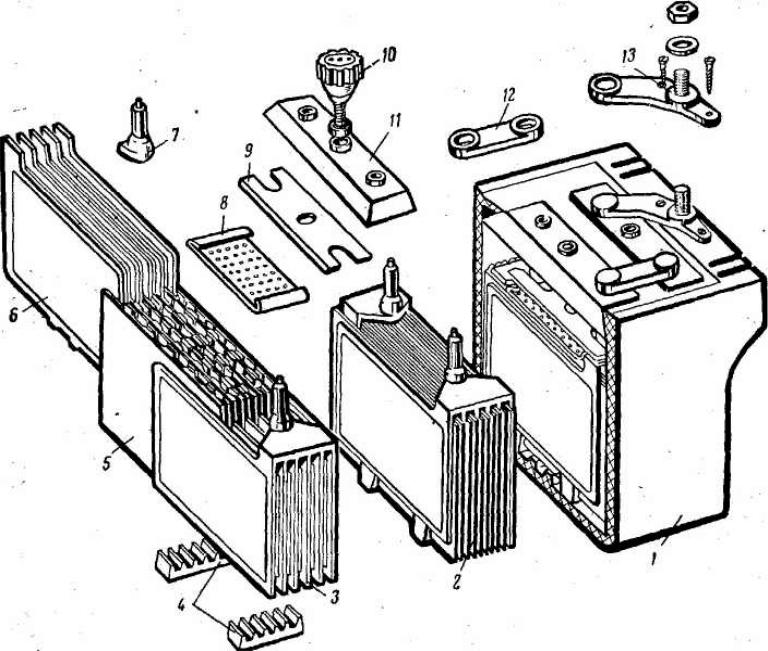 Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушачьей лапки на самом деле вызываются разными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из пакета цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытекал из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления для гальванической сваи
Уильям Круикшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химия вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, и свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначались для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею с цинковым анодом, катодом из диоксида марганца и раствором хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую батарею с «сухими элементами» в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> 3V угольно-цинковая батарея 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ Commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Компания Asahi Chemical из Японии создала первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году.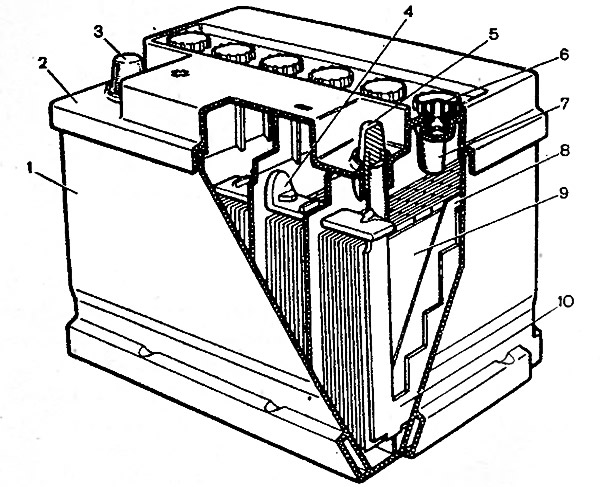 В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но идею вы поняли.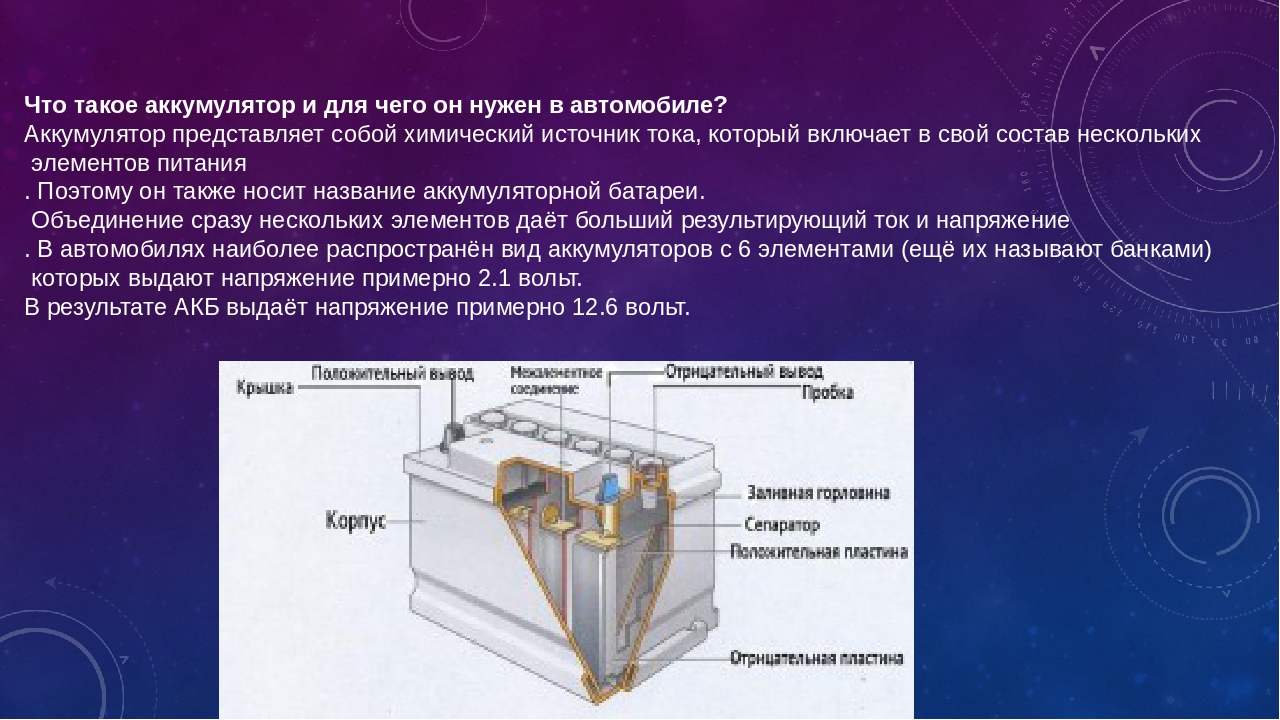 Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Лучшее поперечное сечение щелочной ячейки можно найти в Википедии. И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят перейти к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут с на катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде. Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, которое способно переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены.
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству аккумуляторов требуется способ удерживать их химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса батареймогут быть изготовлены практически из чего угодно: из пластика, стали, пакетов из мягкого полимерного ламината и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной корпус соединен с катодом.
Операция
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри или вокруг анода, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде дает дополнительные электроны в процессе, называемом окислением , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию окисления-восстановления или окислительно-восстановительную реакцию, на две отдельные части. При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначенные как e — ).
В некоторых реакциях окисления образуются ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже если батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задымляются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», чтобы достичь чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Разряженная батарея
Химические вещества в батарее в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем пропускания через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении батареи, емкости, возможности источника тока и так далее.
Ячейка
Элемент относится к одному аноду и катоду, разделенным электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг на друга
Первичный
Первичные клетки содержат химический состав, который нельзя обратить вспять. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, иначе известные как «перезаряжаемые батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумулятор Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение его цикла разряда.
Вместимость
Емкость аккумулятора — это показатель количества электрического заряда, который он может доставить при определенном напряжении. Большинство аккумуляторов рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают зависимость напряжения батареи от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей цепи, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-Rate
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это количество тока, необходимое для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при более высоком потреблении тока. Например, этот график информации о продукте от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких показателях C-Rates.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или меньше.
MIT предлагает фантастическое руководство по спецификациям и терминологии аккумуляторов, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот экран для фотонной батареи питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки 1,5 В подключены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или литий-полимерные батареи последовательно, вам необходимо использовать специальные схемы, известные как «балансировщик», чтобы гарантировать равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельный
Если напряжение одного элемента соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какие-либо различия в напряжении, может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Последовательный и параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, так как может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батареи и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
DOE Объясняет…Батареи | Министерство энергетики
Аккумуляторы и аналогичные устройства принимают, хранят и отпускают электроэнергию по запросу. Батареи используют химию в форме химического потенциала для хранения энергии, как и многие другие повседневные источники энергии. Например, бревна хранят энергию в своих химических связях, пока при горении энергия не преобразуется в тепло. Бензин — это запасенная химическая потенциальная энергия, пока она не преобразуется в механическую энергию в двигателе автомобиля. Точно так же, чтобы батареи работали, электричество должно быть преобразовано в форму химического потенциала, прежде чем оно может быть легко сохранено.Батареи состоят из двух электрических клемм, называемых катодом и анодом, разделенных химическим материалом, называемым электролитом. Чтобы принимать и высвобождать энергию, батарея подключается к внешней цепи. Электроны движутся по цепи, в то время как одновременно ионы (атомы или молекулы с электрическим зарядом) движутся через электролит. В перезаряжаемой батарее электроны и ионы могут двигаться в любом направлении через цепь и электролит. Когда электроны движутся от катода к аноду, они увеличивают химическую потенциальную энергию, таким образом заряжая аккумулятор; когда они движутся в другом направлении, они преобразуют эту химическую потенциальную энергию в электрическую цепь и разряжают батарею.Во время зарядки или разрядки противоположно заряженные ионы перемещаются внутри батареи через электролит, чтобы уравновесить заряд электронов, проходящих через внешнюю цепь, и создать устойчивую перезаряжаемую систему. После зарядки аккумулятор может быть отключен от цепи для хранения химической потенциальной энергии для последующего использования в качестве электричества.
Батареи были изобретены в 1800 году, но их химические процессы сложны. Ученые используют новые инструменты, чтобы лучше понять электрические и химические процессы в батареях, чтобы создать новое поколение высокоэффективных аккумуляторов электроэнергии.Например, они разрабатывают улучшенные материалы для анодов, катодов и электролитов в батареях. Ученые изучают процессы в аккумуляторных батареях, потому что они не полностью меняются, когда батарея заряжается и разряжается. Со временем отсутствие полной замены может изменить химический состав и структуру материалов батареи, что может снизить производительность и безопасность батареи.
Департамент науки и хранения электроэнергии Министерства энергетики США
Исследования, проведенные при поддержке Управления науки Министерства энергетики США и Управления фундаментальных энергетических наук (BES), привели к значительным улучшениям в хранении электроэнергии.Но мы все еще далеки от комплексных решений для хранения энергии следующего поколения с использованием совершенно новых материалов, которые могут значительно увеличить количество энергии, которое может хранить аккумулятор. Это хранилище имеет решающее значение для интеграции возобновляемых источников энергии в нашу систему электроснабжения. Поскольку усовершенствование аккумуляторных технологий имеет важное значение для повсеместного использования подключаемых к электросети электромобилей, хранение также является ключом к уменьшению нашей зависимости от нефти при транспортировке.
BES поддерживает исследования отдельных ученых и в многопрофильных центрах.Самый крупный центр — Объединенный центр исследований в области накопления энергии (JCESR), центр энергетических инноваций Министерства энергетики США. Этот центр изучает электрохимические материалы и явления на атомном и молекулярном уровне и использует компьютеры для разработки новых материалов. Эти новые знания позволят ученым разработать более безопасные накопители энергии, которые служат дольше, заряжаются быстрее и обладают большей емкостью. По мере того как ученые, поддерживаемые программой BES, достигают новых успехов в науке об аккумуляторах, эти достижения используются прикладными исследователями и промышленностью для продвижения приложений в области транспорта, электросетей, связи и безопасности.
Факты о хранении электрической энергии
- Нобелевская премия по химии 2019 года была присуждена совместно Джону Б. Гуденафу, М. Стэнли Уиттингему и Акире Йошино «за разработку литий-ионных батарей».
- Электролитный геном в JCESR создал вычислительную базу данных с более чем 26 000 молекул, которую можно использовать для расчета ключевых свойств электролита для новых, усовершенствованных аккумуляторов.
Ресурсы и связанные термины
Научные термины могут сбивать с толку.DOE Explains предлагает простые объяснения ключевых слов и концепций фундаментальной науки. В нем также описывается, как эти концепции применяются к работе, которую проводит Управление науки Министерства энергетики США, поскольку это помогает Соединенным Штатам преуспевать в исследованиях по всему научному спектру.
Школа инженерии Массачусетского технологического института | »Как работает аккумулятор?
Как работает аккумулятор?
Ваши часы, ноутбук и лазерная указка питаются от одного и того же: химии…
Мэри БейтсСуществует много разных типов батарей, но все они работают на основе одной и той же концепции.«Батарея — это устройство, способное накапливать электрическую энергию в форме химической энергии и преобразовывать эту энергию в электричество», — говорит Антуан Алланор, научный сотрудник отдела материаловедения и инженерии Массачусетского технологического института. «Вы не можете улавливать и хранить электричество, но вы можете хранить электрическую энергию в химических веществах внутри батареи».
Батарея состоит из трех основных компонентов: две клеммы, сделанные из разных химикатов (обычно металлов), анод и катод; и электролит, разделяющий эти выводы.Электролит — это химическая среда, которая обеспечивает прохождение электрического заряда между катодом и анодом. Когда устройство подключено к батарее — лампочке или электрической цепи — на электродах происходят химические реакции, которые создают поток электрической энергии к устройству.
Более конкретно: во время разряда электричества химическое вещество на аноде высвобождает электроны на отрицательный вывод и ионы в электролите в результате так называемой реакции окисления.Между тем, на положительном выводе катод принимает электроны, замыкая цепь для потока электронов. Электролит предназначен для того, чтобы привести различные химические вещества анода и катода в контакт друг с другом таким образом, чтобы химический потенциал мог уравновеситься от одного вывода к другому, преобразовывая накопленную химическую энергию в полезную электрическую энергию. «Эти две реакции происходят одновременно», — говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и это то, что генерирует электрический ток.”
Если батарея одноразовая, она будет вырабатывать электричество до тех пор, пока не закончатся реагенты (одинаковый химический потенциал на обоих электродах). Эти батареи работают только в одном направлении, преобразуя химическую энергию в электрическую. Но в других типах аккумуляторов реакция может быть обратной. Перезаряжаемые батареи (например, в вашем мобильном телефоне или в вашем автомобиле) сконструированы таким образом, что электрическая энергия из внешнего источника (зарядное устройство, которое вы подключаете к стене или динамо-машина в вашем автомобиле) может подаваться на химическую систему и наоборот. его работу, восстанавливая заряд аккумулятора.
Лаборатория Group Sadoway в Массачусетском технологическом институте работает над созданием более эффективных батарей для многоцелевого использования. Для крупномасштабного хранения энергии команда работает над жидкометаллической батареей, в которой электролит, анод и катод являются жидкими. Для портативных приложений они разрабатывают тонкопленочные полимерные батареи с гибким электролитом из негорючего геля. Другой целью лаборатории является создание батарей с использованием ранее не рассматриваемых материалов, уделяя особое внимание распространенным, дешевым и безопасным веществам, которые имеют такой же коммерческий потенциал, как и популярные литиевые батареи.
Спасибо 18-летнему Стивену Минкусу из Гленвью, штат Иллинойс, за этот вопрос.
Отправлено: 1 мая 2012 г.
Как работают батарейки?
Как работают батарейки?Как работают батарейки?
Электричество, как вы, наверное, уже знаете, это поток электронов через токопроводящую дорожку, как провод. Этот путь называется цепью .
Батареи состоят из трех частей: анода (-), катода (+), и электролит .Катод и анод (положительный и отрицательный стороны на обоих концах традиционной батареи) подключены к электрическому схема.
Химические реакции в батарее вызывают накопление электронов на аноде. Это приводит к электрической разнице между анодом и катод. Вы можете думать об этой разнице как о нестабильном накоплении электроны. Электроны хотят перестроиться, чтобы избавиться от этой разницы.Но они делают это определенным образом. Электроны отталкиваются друг от друга и пытаются уйти в место с меньшим количеством электронов.
В батарее единственное место, куда можно подойти, — это катод. Но электролит не дает электронам идти прямо от анода к катоду внутри батареи. Когда цепь замкнута (провод соединяет катод и анод) электроны смогут попасть на катод. На картинке выше электроны проходят по проводу, зажигая лампочку вдоль способ.Это один из способов описания того, как электрический потенциал вызывает появление электронов. протекать по контуру.
Однако эти электрохимические процессы изменяют химические вещества. в аноде и катоде, чтобы они перестали подавать электроны. Итак, есть ограниченное количество энергии, доступной в батарее.
Когда вы перезаряжаете батарею, вы меняете направление потока электронов с помощью другого источника энергии, например солнечных батарей.В электрохимические процессы происходят в обратном порядке, и анод и катод восстанавливаются в исходное состояние и снова может обеспечить полную мощность.
Что есть батареи?
Что это энергия?
Что такое схема?
Что такое электрон?
Что такое поток электронов?
Что такое DS1 срок службы батареи?
Что значит электрически заряженный?
Как атомы заряжены?
Где энергия приходит и уходит?
В чем разница между элементом, батареей и аккумуляторным блоком? — BatteryGuy.com База знаний
Быстрый ответ
Батарейный блок состоит из двух или более батарей, соединенных вместе последовательно или параллельно (более подробную информацию об этих двух методах подключения см. В разделе «Построение батарейного блока с использованием батарей в ампер-часах»).
Батарея состоит из одной или нескольких ячеек. Батарею с одним элементом часто называют «одноячеечной батареей ». Когда имеется более одной ячейки, они соединяются вместе внутри последовательно, но снаружи они обычно выглядят как единый элемент (одна положительная и одна отрицательная клемма).
Элемент в своей простейшей форме, когда мы говорим о батареях, представляет собой один металлический катод (положительный), один металлический анод (отрицательный) и электролит. Металлы, используемые в катоде и аноде, а также жидкость или материал, из которого состоит электролит, различаются, поскольку за последние два столетия были обнаружены различные комбинации, каждая из которых имеет разные сильные и слабые стороны.
Ячейка
В базовом элементе батареи используются два куска разных металлов — катод , (положительный) и анод , (отрицательный).Внутри они разделены, но оба находятся в контакте с одним и тем же электролитом, где происходят химические реакции, которые создают электрический заряд.
Используемые металлы различаются в зависимости от типа батареи. Ключ иногда кроется в названии — свинцово-кислотные батареи действительно используют пластины свинца с активной пастой губчатого свинца, нанесенной на отрицательные анодные пластины, и пластины из диоксида свинца на положительный катод. Электролит кислота . В других случаях название вводит в заблуждение.Лития нет, например, в литий-ионном аккумуляторе.
Электролит может сильно варьироваться от полностью жидкой кислоты до влажной пасты и сухого порошка, но именно здесь происходит химическая реакция, которая производит электричество, когда катод и анод соединяются друг с другом через внешнее устройство, такое как как лампочка.
Если бы катод и анод были соединены друг с другом напрямую, произошла бы такая же химическая реакция, но без какого-либо устройства для ее замедления выделяется огромное количество тепла, которое может привести к взрывам или пожарам.
На самом деле необходимость делать батареи небольшими означает, что катод и анод часто находятся очень близко друг к другу, и поэтому большинство современных элементов включают сепаратор , пористый материал (обычно в форме листа), чтобы гарантировать, что катод и анод не касайтесь, позволяя электролиту или его частям свободно перемещаться между ними.
Подробнее о том, как работает элемент, см. Как работает аккумулятор.
Одноэлементные батареи
Большинство бытовых батарей, таких как те, которые используются в пультах дистанционного управления и будильниках, на самом деле являются элементами, но эта ошибка наименования стала обыденным языком, хотя технически это неверно.
Некоторые люди называют их одноэлементными батареями, , но если задуматься, это противоречие. Батарея определяется как «набор аналогичных единиц», а отдельная ячейка не является набором.
Но мы не собираемся менять словарный запас в ближайшее время, поэтому принято считать, что батарея может состоять из одной или нескольких ячеек. Оксфордский словарь определяет батарею как «контейнер, состоящий из одной или нескольких ячеек, в которых химическая энергия преобразуется в электричество и используется в качестве источника энергии»:
Эти обычные бытовые батареи на самом деле представляют собой элементы, иногда называемые «одноэлементными» батареями.Аккумулятор
Ячейкисами по себе не обладают большой мощностью. Никель-металлогидридные элементы имеют напряжение 1,2 вольт, в то время как даже самые современные литиевые элементы достигают всего 3,5 вольт. Для многих небольших приложений, таких как светодиодные фонарики, подойдет любая химия. Когда дело доходит до чего-то более сложного, например, запуска двигателя, ни одна ячейка не справится.
Таким образом, создание единого продукта, содержащего несколько соединенных вместе ячеек, было очевидным решением. Стартерная батарея для автомобильного двигателя обычно состоит из 6 свинцово-кислотных элементов, каждый с напряжением 2, соединенных последовательно для создания 12-вольтовой батареи.На самом деле каждая ячейка обычно имеет напряжение 2,1 В, а батарея — 12,7 В, но для коммерческой простоты они называются батареями на 12 В.
В этой ситуации мы имеем настоящую «батарею» элементов.
Аккумуляторный блок
Две 12-вольтовые батареи, соединенные последовательно, чтобы создать батарею с перекрестным напряжением 24 вольт. Изображение: Кевин Паркер HorseboxesХотя создание отдельных продуктов с несколькими ячейками — лучшее решение, существуют ограничения. Свинцово-кислотную батарею, содержащую десятки ячеек, было бы невозможно поднять, и поэтому она непрактична.Если бы одна ячейка вышла из строя, затраты на ремонт или замену также были бы чрезмерно высокими.
Поэтому, когда вам нужно еще больше энергии, лучшим решением будет соединить несколько батарей вместе. Это аккумуляторная батарея.
То, как вы соединяете их вместе, влияет на конечную силу тока или напряжение аккумуляторной батареи (см. Создание аккумуляторной батареи с батареями в ампер-часах для примеров и объяснения того, как это работает).
Батарейный блок может состоять из одноэлементных батарей или многоэлементных батарей.Один повседневный пример соединения нескольких ячеек последовательно друг с другом часто можно встретить на больших грузовиках, где у нас есть:
- две батареи, каждая из которых содержит шесть элементов по 2 В для производства 12 В
- , соединенные последовательно для создания аккумуляторной батареи с напряжением перекрестной цепи 24 В
Такой подход обеспечивает достаточную мощность для запуска больших дизельных двигателей. Для выполнения той же работы может быть изготовлена отдельная батарея, но она будет настолько тяжелой и большой, что ее подъем и перемещение могут быть выполнены с огромными трудностями.
Почему это сбивает с толку
Основная причина путаницы на самом деле связана с нашим принятием называть одноэлементную батарею батареей. Давайте посмотрим на это в действии.
Если вы откроете аккумулятор ноутбука или электроинструмента, то вы обнаружите внутри то, что выглядит как множество небольших аккумуляторов, соединенных вместе, как показано на рисунке ниже:
Внутри аккумулятор ноутбука. Изображение от In2systems TechnologiesТеперь, если вы прищурите глаза, вы увидите, что фиолетовые блоки внутри имеют маркировку Samsung ICR18650-26C.Посмотрите, и вы обнаружите, что большинство людей называют ICR18650-26C «батареей».
Так разве это не значит, что то, что у вас сзади ноутбука, — это аккумуляторный блок, а не аккумулятор? Нет. Ошибка заключается в том, что ICR18650-26C на самом деле является аккумулятором (технически его не следует называть аккумулятором, но все так и поступают), поэтому аккумулятор вашего ноутбука на самом деле представляет собой аккумулятор, состоящий из нескольких элементов. Каждый Samsung ICR18650-26C представляет собой ячейку, как показано на рисунке.
Этот щелочной блок A134 выглядит как одноэлементный аккумулятор, но на самом деле состоит из нескольких элементов.Однако внешность тоже может быть обманчива. Изображенная здесь батарея выглядит как одноячеечная, но на самом деле состоит из нескольких меньших ячеек, упакованных вместе в вакуумной упаковке.
Это «батарея» элементов в прямом смысле этого слова.
Скидка обычно заключается в напряжении. Изображенный пример представляет собой щелочную одноразовую (первичную) батарею A134 на 6 вольт, но щелочные первичные элементы имеют только напряжение перекрестной цепи 1,5 вольт, поэтому мы можем сказать, что эта батарея фактически должна состоять из четырех щелочных одноэлементных батарей, соединенных последовательно. .
.

 Такие АКБ устанавливаются на технику с двигателями внутреннего сгорания.
Такие АКБ устанавливаются на технику с двигателями внутреннего сгорания.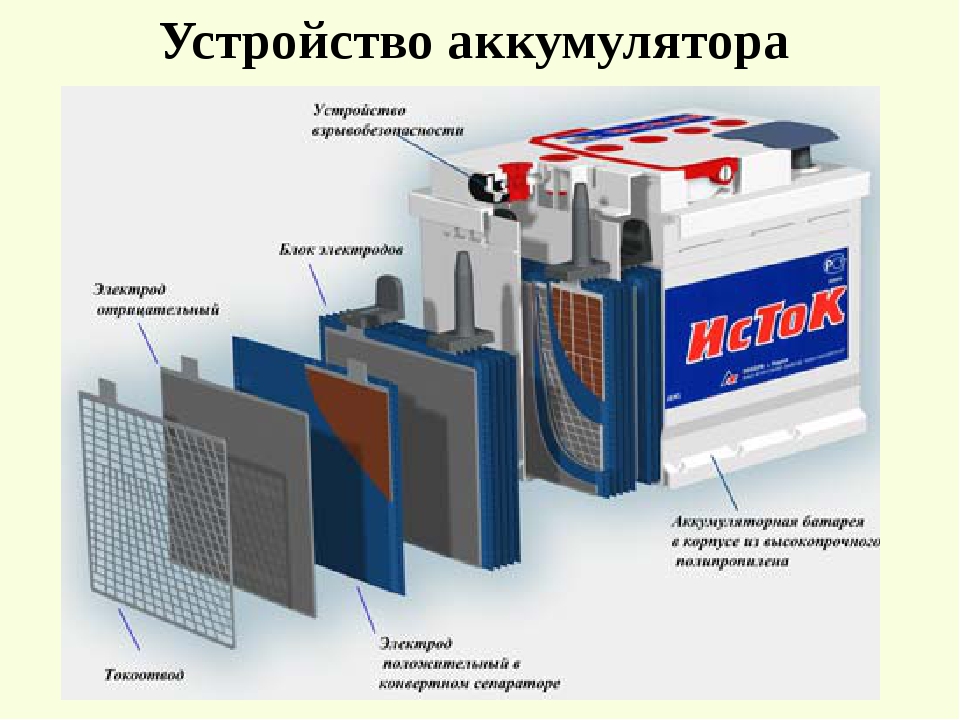 Это позволило создать необслуживаемые батареи, которые практически не требуют вмешательства. В отличие от кальциевых и гелиевых батарей, малосурьмянистые менее требовательны к показателям напряжения бортовой сети. Если напряжение на генераторе превышает норму, АКБ не разрушаются и не теряет емкость.
Это позволило создать необслуживаемые батареи, которые практически не требуют вмешательства. В отличие от кальциевых и гелиевых батарей, малосурьмянистые менее требовательны к показателям напряжения бортовой сети. Если напряжение на генераторе превышает норму, АКБ не разрушаются и не теряет емкость.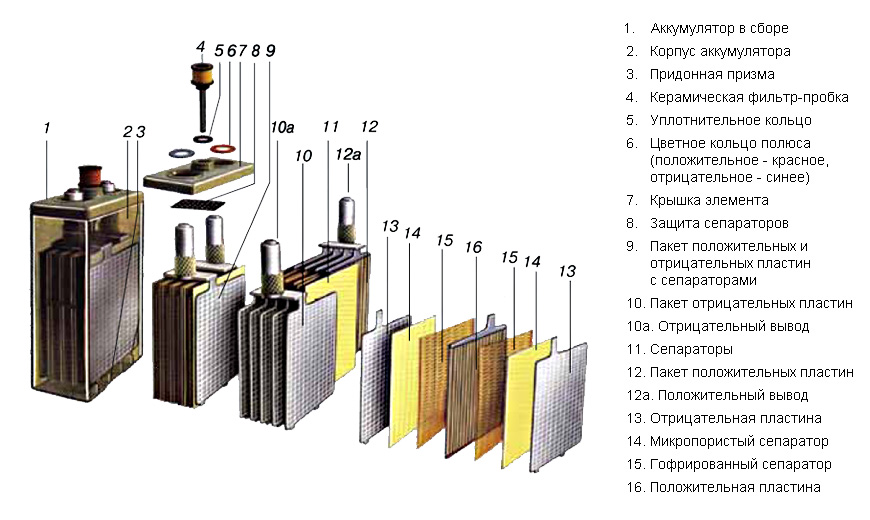 Электролит в них находится в связанном гелеобразном состоянии. Это исключает возможность утечки кислоты при повреждении или опрокидывании аккума. AGM-устройства заполнены пористым материалом, предотвращающим осыпание пластин. Высокая цена, резкое падение емкости при низкой температуре и уязвимость к большому току заряда делает их востребованными лишь на дорогих иномарках, оборудованных системами «стоп-старт».
Электролит в них находится в связанном гелеобразном состоянии. Это исключает возможность утечки кислоты при повреждении или опрокидывании аккума. AGM-устройства заполнены пористым материалом, предотвращающим осыпание пластин. Высокая цена, резкое падение емкости при низкой температуре и уязвимость к большому току заряда делает их востребованными лишь на дорогих иномарках, оборудованных системами «стоп-старт».
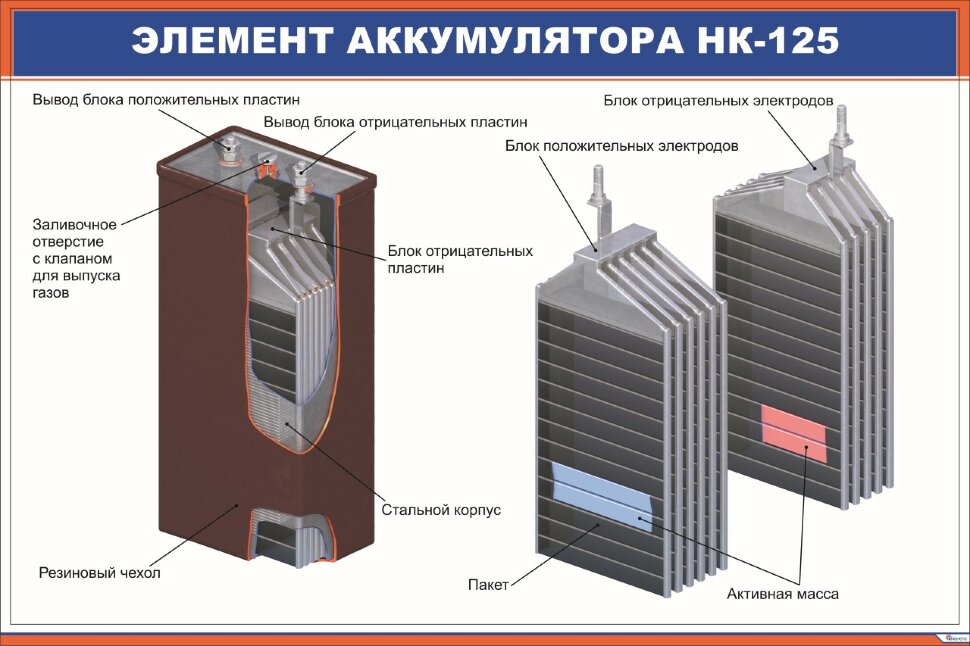 Его роль – минимизировать выделение газа и расход воды. Такие батареи можно устанавливать в жилых помещениях.
Его роль – минимизировать выделение газа и расход воды. Такие батареи можно устанавливать в жилых помещениях.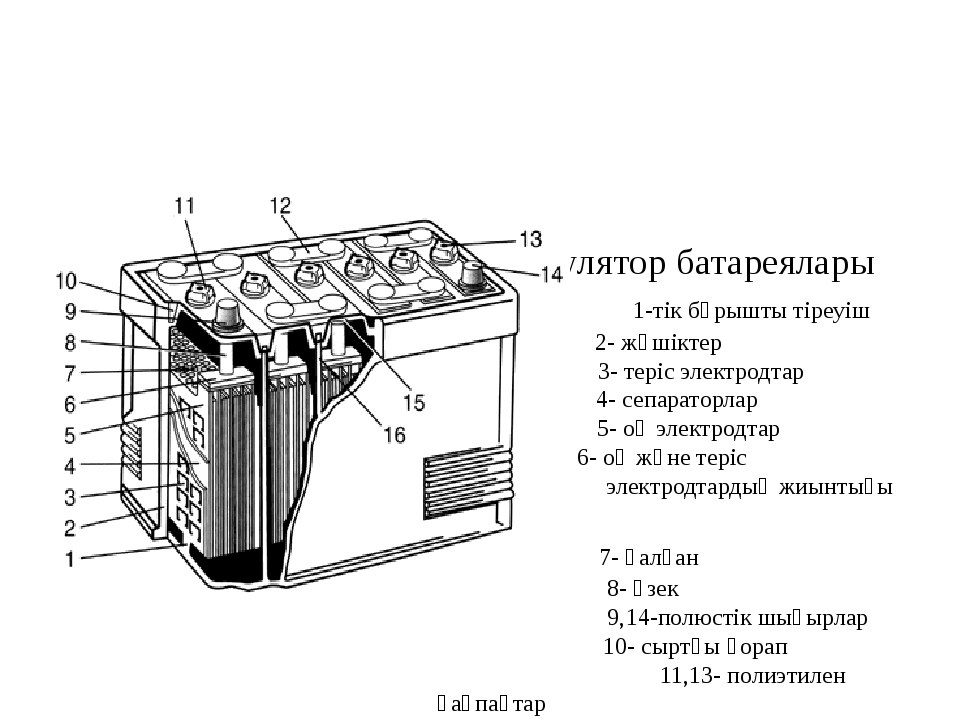 Служит также около 20 лет. Выпускается в виде АКБ с напряжением от 2 до 125 В.
Служит также около 20 лет. Выпускается в виде АКБ с напряжением от 2 до 125 В.